
【题目】下列说法不正确的是
A.25℃时将10mLpH=11的氨水加水稀释至100mL时氨水的浓度是0.01mol/L(氨水的Kb=1×10-5)
B.室温下向10mLpH=3的醋酸溶液中加水稀释,溶液中![]() 不变
不变
C.现有浓度均为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,分别用以上三种酸溶液中和一定量的NaOH溶液,反应后溶液呈中性,需要酸溶液的体积分别为V1、V2、V3,其大小关系为V3> V1> V2
D.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,盐酸所加的水量多,说明盐酸是强酸,醋酸是弱酸
【答案】D
【解析】
A. 25℃时,10mLpH=11的氨水中c(CH3COOH)=![]() =
=![]() =0.1mol/L,加水稀释至100mL时氨水的浓度是0.01mol/L,A正确;
=0.1mol/L,加水稀释至100mL时氨水的浓度是0.01mol/L,A正确;
B. 室温下向10mLpH=3的醋酸溶液中加水稀释,溶液中![]() =
=![]() ,Ka、Kw只受温度的影响,不受浓度变化的影响,B正确;
,Ka、Kw只受温度的影响,不受浓度变化的影响,B正确;
C. 浓度均为0.1 mol·L-1的盐酸、硫酸、醋酸,c(H+)分别为0.1mol/L、0.2mol/L、0.1mol/L,中和一定量的NaOH溶液,当溶液呈中性,可得0.1V1=0.2V2<0.1V3(醋酸钠溶液呈碱性,醋酸应过量),从而得出V3> V1> V2,C正确;
D. 将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量多,说明醋酸加水稀释后,n(H+)增大,从而说明盐酸是强酸,醋酸是弱酸,D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:

已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
开始沉淀时 | 1.9 | 3.4 | 7.0 | 9.1 |
完全沉淀时 | 3.2 | 4.7 | 9.0 | 11.1 |
(1)上述流程中能加快反应速率的措施有______、_______等。
(2)酸浸时发生反应:2MgO·SiO2 + 2H2SO4=2MgSO4 + SiO2 + 2H2O,2MgO·B2O3+ 2H2SO4 + H2O=2H3BO3 + 2MgSO4。
①上述反应体现出酸性强弱:H2SO4______H3BO3(填“>”或“<”)。
② 酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的离子方程式:______、______。
③ 已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3 + OH- B(OH)4-。下列关于硼酸的说法正确的是__(填序号)。
a. 硼酸是一元酸
b. 向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
c. 硼酸的电离方程式可表示为:H3BO3 + H2O![]() B(OH)4-+H+
B(OH)4-+H+
(3)检验褐色浸出液中的杂质离子:取少量浸出液,______(填操作和现象),证明溶液中含有Fe2+。
(4)除去浸出液中的杂质离子: 用MgO调节溶液的pH至______以上,使杂质离子转化为______(填化学式)沉淀,过滤。
(5)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合下图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,______(将方法补充完整)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)盛装0.2000 mol/L盐酸标准液应该用__式滴定管。
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视__;终点判断方法:_________________
(3)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器
⑥滴定操作
正确的操作顺序为:_____
(4)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20. 00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为______mol/L(保留四位有效数字)
(5)若滴定时锥形瓶未干燥,则测定结果________;若滴定前平视读数,滴定终点时仰视读数,则会使所测碱的浓度值________。(填“无影响”、“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O Ba2++CrO
+H2O Ba2++CrO![]() ===BaCrO4↓
===BaCrO4↓
步骤Ⅰ移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。BaCl2溶液的浓度为________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )

A. 途径②增大O2浓度可提高SO2转化率
B. 含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C. 途径②中SO2和SO3均属于酸性氧化物
D. 若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1) +O2(g)为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体M的合成路线流程图

已知信息:
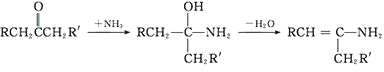
RCHO+ →
→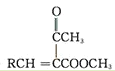 +H2O
+H2O
请回答下列问题:
![]() 下列说法中正确的是__________。
下列说法中正确的是__________。
A.化合物A只有1种结构可以证明苯环不是单双键交替的结构
B.可利用酸性![]() 溶液实现
溶液实现![]() 的转换
的转换
C.步骤![]() 、
、![]() 、
、![]() 所属的有机反应类型各不相同
所属的有机反应类型各不相同
D.化合物C具有弱碱性
![]() 化合物F的结构简式是__________。
化合物F的结构简式是__________。
![]() 步骤
步骤![]() 可得到一种与G分子式相同的有机副产物,其结构简式是__________。
可得到一种与G分子式相同的有机副产物,其结构简式是__________。
![]() 写出
写出![]() 的化学方程式__________。
的化学方程式__________。
![]() 写出
写出![]() 同时符合下列条件的同分异构体的结构简式__________。
同时符合下列条件的同分异构体的结构简式__________。
![]() 分子中具有联苯结构,能与
分子中具有联苯结构,能与![]() 溶液发生显色反应,能发生水解反应与银镜反应,且完全水解后只有两种物质的量之比为
溶液发生显色反应,能发生水解反应与银镜反应,且完全水解后只有两种物质的量之比为![]() 的水解产物;
的水解产物;![]() 谱和IR谱检测表明分子中有7种化学环境不同的氢原子,没有
谱和IR谱检测表明分子中有7种化学环境不同的氢原子,没有![]() 键。
键。
![]() 已知:CH3CHO+HCHO
已知:CH3CHO+HCHO![]() H2C=CHCHO,设计以
H2C=CHCHO,设计以![]() 、
、![]() 和
和 为原料制备
为原料制备 的合成路线流程图________________(无机试剂任选)。
的合成路线流程图________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:①H2(g)+![]() O2(g)=H2O(l)ΔH=-285.8kJ/mol②H2(g)+
O2(g)=H2O(l)ΔH=-285.8kJ/mol②H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8kJ/mol③C(s)+
O2(g)=H2O(g)ΔH=-241.8kJ/mol③C(s)+ ![]() O2(g)=CO(g)ΔH=―110.4 kJ/mol④C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol。回答下列各问:
O2(g)=CO(g)ΔH=―110.4 kJ/mol④C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol。回答下列各问:
(1)上述反应中属于放热反应的是_______。(填序号)
(2)H2的燃烧热为___;C的燃烧热为____。
(3)燃烧4g H2生成液态水,放出的热量为_______。
(4)根据盖斯定律可知CO的燃烧热为_____;其热化学方程式为_____。
(5)比较下列各组热化学方程式中△H的大小:
①C(s)+O2(g)=CO2(g)△H1 C(s)+![]() O2(g)=CO(g) △H2 △H1 ____△H2
O2(g)=CO(g) △H2 △H1 ____△H2
②S(s)+O2(g)=SO2(g)△H3 S(g)+O2(g)=SO2(g) △H4 △H3 __△H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com