
����Ŀ��ҩ���м���M�ĺϳ�·������ͼ

��֪��Ϣ��
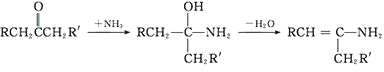
RCHO+ ��
�� +H2O
+H2O
��ش��������⣺
![]() ����˵������ȷ����__________��
����˵������ȷ����__________��
A.������Aֻ��1�ֽṹ����֤���������ǵ�˫������Ľṹ
B.����������![]() ��Һʵ��
��Һʵ��![]() ��ת��
��ת��
C.����![]() ��
��![]() ��
��![]() �������л���Ӧ��������ͬ
�������л���Ӧ��������ͬ
D.������C����������
![]() ������F�Ľṹ��ʽ��__________��
������F�Ľṹ��ʽ��__________��
![]() ����
����![]() �ɵõ�һ����G����ʽ��ͬ���л��������ṹ��ʽ��__________��
�ɵõ�һ����G����ʽ��ͬ���л��������ṹ��ʽ��__________��
![]() �
д��![]() �Ļ�ѧ����ʽ__________��
�Ļ�ѧ����ʽ__________��
![]() �
д��![]() ͬʱ��������������ͬ���칹��Ľṹ��ʽ__________��
ͬʱ��������������ͬ���칹��Ľṹ��ʽ__________��
![]() �����о��������ṹ������
�����о��������ṹ������![]() ��Һ������ɫ��Ӧ���ܷ���ˮ�ⷴӦ��������Ӧ������ȫˮ���ֻ���������ʵ���֮��Ϊ
��Һ������ɫ��Ӧ���ܷ���ˮ�ⷴӦ��������Ӧ������ȫˮ���ֻ���������ʵ���֮��Ϊ![]() ��ˮ����
��ˮ����![]() ��IR��������������7�ֻ�ѧ������ͬ����ԭ�ӣ�û��
��IR��������������7�ֻ�ѧ������ͬ����ԭ�ӣ�û��![]() ����
����
![]() ��֪��CH3CHO+HCHO
��֪��CH3CHO+HCHO![]() H2C=CHCHO�������
H2C=CHCHO�������![]() ��
��![]() ��
�� Ϊԭ���Ʊ�
Ϊԭ���Ʊ� �ĺϳ�·������ͼ________________(���Լ���ѡ)��
�ĺϳ�·������ͼ________________(���Լ���ѡ)��
���𰸡�![]()
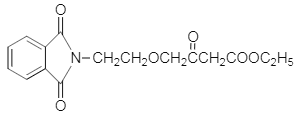
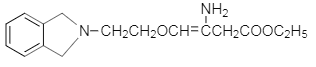
![]()
![]()
![]()
![]()
 ��
�� ��
��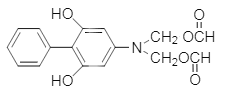 ��
��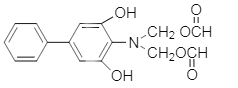 CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]()

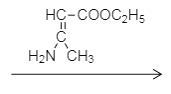
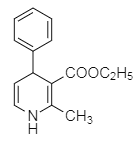
![]()
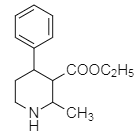
��������
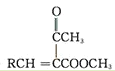
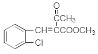
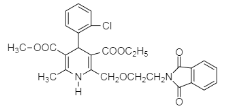
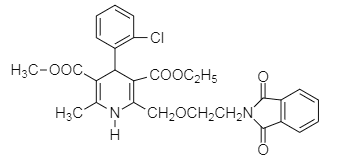
����ҩ���м���M�ĺϳ�·������ͼ����D�Ľṹ��ʽ��A�ķ���ʽ��֪��AΪ�ڶ��ױ�![]() ����BΪ�ڱ��������D��E�Ľṹ��ʽ��C�ķ���ʽ��֪��CΪH2NCH2CH2OH�����ݵ�һ����֪��Ϣ��G�Ľṹ��֪��FΪ
����BΪ�ڱ��������D��E�Ľṹ��ʽ��C�ķ���ʽ��֪��CΪH2NCH2CH2OH�����ݵ�һ����֪��Ϣ��G�Ľṹ��֪��FΪ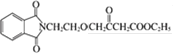 ������M�Ľṹ�͵ڶ�����֪��Ϣ��֪HΪ
������M�Ľṹ�͵ڶ�����֪��Ϣ��֪HΪ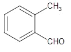 ����IΪ
����IΪ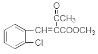 ��
��
(1)A. AΪ�ڶ��ױ����ڶ��ױ�ֻ��һ�ֽṹ֤���������ǵ�˫������Ľṹ����A��ȷ��
B. BΪ�ڱ������ᣬ����������![]() ��Һ����A���ɣ���B��ȷ��
��Һ����A���ɣ���B��ȷ��
C. ���ݷ�Ӧǰ�����ʵķ���ʽ���ṹ��ʽ�������֪��Ϣ�ɵã���Ϊȡ����Ӧ����Ϊ�ӳɷ�Ӧ����Ϊ��ȥ��Ӧ����C��ȷ��
D. CΪ![]() �����������������ԣ���D��ȷ��
�����������������ԣ���D��ȷ��
����ABCD��
(2)�ɢܵķ�Ӧ��ṹ��ʽ��֪��FΪ ����Ϊ��
������  ��
��
(3)F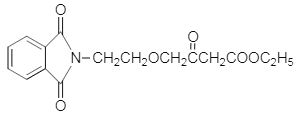 ��
��![]() �����ӳɷ�Ӧ������ȥ��Ӧ���ǻ�����̼ԭ�ӵ���������̼ԭ���϶�����ԭ�ӣ����ܷ�����ȥ��Ӧ������Ľṹ��ʽΪ
�����ӳɷ�Ӧ������ȥ��Ӧ���ǻ�����̼ԭ�ӵ���������̼ԭ���϶�����ԭ�ӣ����ܷ�����ȥ��Ӧ������Ľṹ��ʽΪ ����Ϊ��
������  ��
��
(4)����ϢRCHO+ ��
��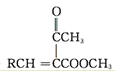 +H2O��M��G�Ľṹ��ʽ��֪��HΪ���ȱ���ȩ����IΪ
+H2O��M��G�Ľṹ��ʽ��֪��HΪ���ȱ���ȩ����IΪ ��
��![]() �Ļ�ѧ����ʽΪ
�Ļ�ѧ����ʽΪ
![]()
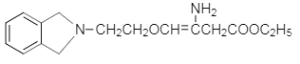
![]()
![]() ������
������ 
![]()
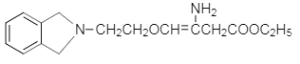
![]()

![]() ��
��
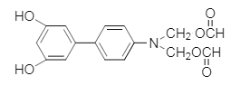
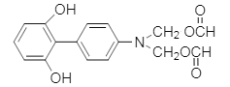
(5)����![]() ��Һ������ɫ��Ӧ�������ǻ����ܷ���ˮ�ⷴӦ��������Ӧ����������ȩ���������������������Ϣ��֪����ṹ�Գƣ�����Ҫ��Ľṹ��ʽΪ��
��Һ������ɫ��Ӧ�������ǻ����ܷ���ˮ�ⷴӦ��������Ӧ����������ȩ���������������������Ϣ��֪����ṹ�Գƣ�����Ҫ��Ľṹ��ʽΪ��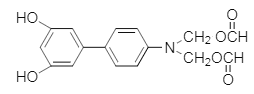 ��
�� ��
�� ��
��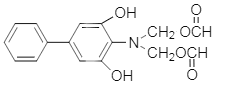 ����Ϊ ��
����Ϊ �� ��
�� ��
�� ��
�� ��
��
(6)�ɺϳ�M�Ĺ����Լ�M�Ľṹ��ʽ���ͼ�����̿ɵúϳ�·��Ϊ��CH3CH2OH![]() CH3CHO
CH3CHO![]()


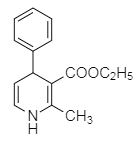
![]()
 ������ CH3CH2OH
������ CH3CH2OH![]() CH3CHO
CH3CHO![]()



![]()
 ��
��


 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д� Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.7��10��5 | K1��4.3��10��7 K2��5.6��10��11 | 3.0��10��8 |
��ش��������⣺
��1��д��H2CO3���뷽��ʽ_________ƽ�ⳣ������ʽKa1(H2CO3)=__________________
��2��CH3COOH��H2CO3��HClO��������ǿ������˳��Ϊ___________
��3����CH3COO������HCO3-����CO32-����ClO�����H����������ǿ������˳��Ϊ��ע�⣺����Ţ١��ڡ��ۡ�������____________________
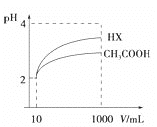
��4�����Ϊ10mLpH=2�Ĵ�����Һ��һԪ��HX��Һ�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ����HX�ĵ���ƽ�ⳣ��__________��������������������������С�����������ƽ�ⳣ����
��5��������CO2����ͨ��NaClO��Һ�У�д����Ӧ�����ӷ���ʽ_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯Ϊ���ȷ�Ӧ���ǣ� ��
A.H2O(g)��H2O(l) ��H����44.0 kJ/mol
B.2HI(g)��H2(g)��I2(g) ��H����14.9 kJ/mol
C.�γɻ�ѧ��ʱ���ų�����862 kJ�Ļ�ѧ��Ӧ
D.�����仯��ͼ��ʾ�Ļ�ѧ��Ӧ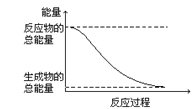
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.25��ʱ��10mLpH=11�İ�ˮ��ˮϡ����100mLʱ��ˮ��Ũ����0.01mol/L(��ˮ��Kb=1��10-5)
B.��������10mLpH=3�Ĵ�����Һ�м�ˮϡ�ͣ���Һ��![]() ����
����
C.����Ũ�Ⱦ�Ϊ0.1 mol��L��1�����ᡢ���ᡢ����������Һ���ֱ���������������Һ�к�һ������NaOH��Һ,��Ӧ����Һ�����ԣ���Ҫ����Һ������ֱ�ΪV1��V2��V3�����С��ϵΪV3> V1> V2
D.�������pH��4������ʹ���ϡ�͵�pH��5����Һ���������ӵ�ˮ���࣬˵��������ǿ�ᣬ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ�У�NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش��������⣺
��1��NH4Al(SO4)2������ˮ������������_______________(�ñ�Ҫ�Ļ�ѧ������������˵��)��
��2����ͬ�����£�0.1 mol/L NH4Al(SO4)2�е�c(NH![]() )________(����������������������С����)0.1 mol/L NH4HSO4�е�c(NH
)________(����������������������С����)0.1 mol/L NH4HSO4�е�c(NH![]() )��
)��
��3����ͼ��0.1 mol/L�������Һ��pH���¶ȱ仯��ͼ��

�����з���0.1 mol/L NH4Al(SO4)2��pH���¶ȱ仯��������________(��д��ĸ)������pH���¶ȱ仯��ԭ����___________________��
��20��ʱ��0.1 mol/L NH4Al(SO4)2��2c(SO![]() )��c(NH
)��c(NH![]() )��3c(Al3��)��________��
)��3c(Al3��)��________��
��4������ʱ����100 mL 0.1 mol/L NH4HSO4��Һ�еμ�0.1 mol/L NaOH��Һ���õ���ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ��
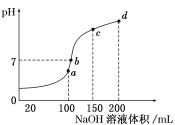
�Է���ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶�������________����b�㣬��Һ�и�����Ũ���ɴ�С������˳����_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ� ��
A.���ִ�����Ϳˢ��п���ᣬ����Ч��ֹ�����ں�ˮ�б���ʴ
B.0.1mol��L-1��ˮ��ˮϡ�ͺ���Һ��![]() ��ֵ��С
��ֵ��С
C.��pH��Ϊ2������ʹ���ֱ��к͵����ʵ�����NaOH�����Ĵ�����������
D.��ӦNH3(g)+HCl(g)=NH4Cl(s)�������¿��Է����У���÷�Ӧ�ġ�H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�У���H ����ȷ��ʾ���ʵı�ȼ���ȵ���
A.CO(g)+ ![]() O2(g)=CO2(g) ��H =-283 kJ/mol
O2(g)=CO2(g) ��H =-283 kJ/mol
B.C(g)+ ![]() O2(g)=CO(g) ��H =-110.5 kJ/mol
O2(g)=CO(g) ��H =-110.5 kJ/mol
C.H2(g)+ ![]() O2(g)=H2O(g) ��H =-248.1 kJ/mol
O2(g)=H2O(g) ��H =-248.1 kJ/mol
D.2C2H2(g)+5O2(g)=2H2O(l)+4CO2(g) ��H =-2300 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��������һ����Ҫ��Ӧ�ǣ�CO(g)+H2O(g)=CO2(g)+H2(g)��
��֪��25��ʱ����C(s)+![]() O2(g)
O2(g)![]() CO(g) H4=-111kJ/mol
CO(g) H4=-111kJ/mol
��H2(g)+![]() O2(g)=H2(g) H2=-242kJ/mol
O2(g)=H2(g) H2=-242kJ/mol
��C(s)+O2(g)=CO2(g) H2=-394kJ/mol
����˵������ȷ���ǣ� ��
A.25��ʱ��![]()
B.����ѹǿ����Ӧ�ٵ�ƽ�����淴Ӧ�����ƣ�ƽ�ⳣ��K��С
C.��Ӧ�ٴﵽƽ��ʱ��ÿ����![]() ��ͬʱ����0.5molO2
��ͬʱ����0.5molO2
D.��Ӧ�ڶϿ�2molH2��1molO2�еĻ�ѧ�������յ��������γ�4molO-H�����ų���������484kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�����£���30mL����������Ļ�������ȼ����ȴ�����£������������Ϊ16mL����ԭ��������м��������������ȣ�____________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com