
����Ŀ���ϳɰ���ҵ�ϳ������з����Ʊ�H2��
�����٣�C��s��+2H2O��g��![]() CO2��g��+2H2��g��
CO2��g��+2H2��g��
�����ڣ�CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
��1����֪��C��ʯī��+O2��g���TCO2��g����H=-394kJmol-1
��2C��ʯī��+O2��g���T2CO2��g����H=-222kJmol-1
��2H2��g��+O2��g���T2H2O��g����H=-484kJmol-1
�Լ���25��ʱ�ɷ������Ʊ�1000gH2���ų�������Ϊ______kJ��
��2����һ���������£���C��s����H2O��g���ֱ����ס��������ܱ�������������Ӧ��C��s��+2H2O��g��![]() CO2��g��+2H2��g��������������±���ʾ��
CO2��g��+2H2��g��������������±���ʾ��

��T1______T2�����������=����������T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=______��
���������У�����Ӧ���е�1.5minʱ��H2O��g�������ʵ���Ũ�ȷ�Χ��______��
�����ܱպ��ݵ������У��ܱ�ʾ������Ӧ�ﵽ��ѧƽ��״̬����______��
A��V�棨CO2��=2V����H2��
B�����������ܶȱ��ֲ���
C��c��H2O����c��CO2����c��H2��=2��1��2
D����������ƽ��Ħ���������ֲ���
��ijͬѧΪ���о���Ӧ�����Ի�ѧƽ���Ӱ�죬����淴Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��

��t1��t3��t5��t7ʱ��Ӧ�����˵�ƽ��״̬�����t2��t4��t6��t8ʱ��ֻ�ı���һ����Ӧ��������t6ʱ�̸ı��������________________________����t1��t8�ĸ�ʱ���H2O��g����ƽ��ת�������______��
���𰸡���1��20500kJ��2����>12.8�ڴ���0.8mol/L��С��1.4mol/L��BD �� ͨ��H2O t7-t8
��������
�����������1�����ݸ�˹������CO��g��+H2O��g��![]() CO2��g��+H2��g��������H=��H1-��H2-��H3=-394kJmol-1-��-111kJmol-1��-��-242kJmol-1��=-41kJmol-1�������Ʊ�1000g H2���ų�������Ϊ41��2��1000= 20500kJ��
CO2��g��+H2��g��������H=��H1-��H2-��H3=-394kJmol-1-��-111kJmol-1��-��-242kJmol-1��=-41kJmol-1�������Ʊ�1000g H2���ų�������Ϊ41��2��1000= 20500kJ��
��2������������¶���ȣ�������ң���ƽ��ʱH2��g��ƽ����Ϊ2.4mol��ʵ������3.2��˵���¶ȸı䣬ƽ�������ƶ���������ӦΪ���ȷ�Ӧ������T1��T2��
�ɱ������ݿ�֪��ƽ��ʱ���������ʵ���Ϊ3.2mol����
C��s��+2H20��g��![]() C02��g��+2H2��g��
C02��g��+2H2��g��
��ʼ��mol����2 4 0 0
ת����mol����1.6 3.2 1.6 3.2
ƽ�⣨mol����0.4 0.8 1.6 3.2
ƽ�ⳣ��K=��1.6��3.22����0.82=12.8��
��3min��ˮ������Ũ�ȱ仯��=������Ũ�ȱ仯����=1.2mol��1L=1.2mol/L�����ŷ�Ӧ�Ľ��У����ʵ�Ũ�Ƚ��ͣ���Ӧ���ʱ�С������ǰ1.5minˮ��Ũ�ȱ仯�����ں�1.5minˮ��Ũ�ȱ仯������Ӧ���е�1.5minʱ��H2O��g�������ʵ���Ũ��С��2mol/L-1.2mol/L��1/2=1.4mol/L��ƽ��ʱ��ˮ������Ũ��Ϊ0.8mol/L������H2O��g�������ʵ���Ũ�ȷ�Χ������0.8mol/L��С��1.4mol/L��
��A����V�棨CO2��=2V����H2�����淴Ӧ����֮�Ȳ����ڻ�ѧ������֮�ȣ��������ٶȲ��ȣ���ѡ��B.�ں����ܱ������У����ŷ�Ӧ�Ľ��У����������������p=m��V���ܶ����������������ܶȱ��ֲ���ʱ��˵�������ٶ���ȣ�ѡ��C������������֮���Ũ�ȹ�ϵ����ʼ��������ת�����йأ��뷴Ӧ�Ƿ�ﵽƽ���أ��ʲ�ѡ��D.��������ƽ����Է�������δƽ��ʱ�ڱ䣬���ڱ��ֲ��䣬˵���Ѵ�ƽ��״̬��ѡ����ѡBD��
��t1��t6ƽ�ⶼ�����ƶ�����t6ʱƽ�������ƶ�������Ϊ���ӷ�Ӧ���Ũ�ȣ���C�ǹ��壬������ͨ��ˮ������ͨ��ˮ�����൱������ѹǿ��ƽ�������ƶ���ˮ������ת���ʽ��ͣ�t8ʱ��Ӧ��������ƽ�ⲻ�ƶ�������ƽ��ת�������t7-t8 ��


 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������ԭ�������������������Ԫ��A��B��C��D��E��F�У�A+���ӣ�B�������̬�⻯������������ЧӦ��Dԭ�Ӻ��������8�ֲ�ͬ���˶�״̬�� E����;��㷺�Ľ�����FԪ�صĻ�̬ԭ�������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӡ�
��1��EԪ�������ڱ��е�λ�� ��F+�ĵ����Ų�ʽΪ ��
��2��������BD(CA2)2�У�Bԭ�ӵ��ӻ���ʽΪ ��1mol�÷����ЦҼ���ĿΪ ����������������ˮ����Ҫԭ���� _ _____________��
��3��ACD3��������CD3���Ŀռ乹��Ϊ ��ACD3���Ա�ACD2ǿ��ԭ����___________��
��4�����ݵȵ�����ԭ����BD���ӵĵ���ʽΪ ��E��BD�γɵĻ�����E(BD)5�۵�253K���е�376K����������� ���塣
��5��3g B2A6������������ȼ�ղ��ָ������£��ų�Q kJ���������ʾB2A6ȼ���ȵ��Ȼ�ѧ����ʽΪ
______ _ _____________��
��6����F���ʷ�ĩ���뵽CA3��Ũ��Һ�У���ͨ��D2����ַ�Ӧ����Һ������ɫ��д���÷�Ӧ�Ļ�ѧ����ʽ _ _____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п����ΪʳƷпǿ������ԭ�ϡ���ҵ�ϳ�����п����������п����п�����Ҫ�ɷ���ZnCO3������������Fe2O3��FeCO3MgO��CaO�ȣ�������������ͼ���£�

��1������п����ĥ�ɷ۵�Ŀ����_____��
��2����������������������з�Ӧ�����ӷ���ʽ����Fe(OH)2+��____+��_____=��Fe(OH)3+��CI-
��3��������(Goethite)���Ե¹�ʫ�˸��(Goethe)���������ģ����Ԫ����Fe��O��H��Ħ������Ϊ89g/mol����ѧʽ��_______����Al��NiO(OH)Ϊ�缫��NaOH��ҺΪ���Һ���һ�����͵�أ��ŵ�ʱ������ת��ΪFe(OH)2���õ�طŵ練Ӧ�Ļ�ѧ����ʽ��__________��
��4�������±����ݣ���������Һ2����pHʱ�������Ͽ�ѡ�õ��������Ϊ______��
������ѧʽ | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
��ʼ������pH | 10��4 | 6��4 | �� | �� |
������ȫ��pH | 12��4 | 8��0 | �� | �� |
��ʼ�ܽ��pH | �� | 10��5 | �� | �� |
Ksp | 5��6�� | �� | 6��8�� | 2��8�� |
��5����ҵ�ϴ�����Һ3����ȡMgO�����У����ʵķ�Ӧ����______(ѡ�����)��
a������ʯ�� b��ʯ���� c��������Һ d����ˮ
��6������Һ4��֮��IJ�������Ϊ______��_______�����ˣ�ϴ�ӣ����
��7������ͼ�����ݣ���п�����ZnCO3����������������________(�ô���ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t��ʱAgCl��Ksp��4��10��10������˵������ȷ����

A. ��t��ʱ��AgBr��KspΪ4.9��10��13
B. ��AgBr������Һ�м���NaBr���壬��ʹ��Һ��c�㵽b��
C. ͼ��a���Ӧ����AgBr�IJ�������Һ
D. ��t��ʱ��AgCl(s)��Br��(aq)![]() AgBr(s)��Cl��(aq)ƽ�ⳣ��K��816
AgBr(s)��Cl��(aq)ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��5�л���ѧ������
�߷��Ӳ���PET������֬��PMMA�ĺϳ�·�����£�

��֪��
��. RCOOR��+ R��18OH![]() RCO18OR��+R��OH��R��R����R������������
RCO18OR��+R��OH��R��R����R������������
![]()
![]() ��.
��.  ��R��R������������
��R��R������������
��1���ٵķ�Ӧ������________��
��2���ڵĻ�ѧ����ʽΪ________��
��3��PMMA���������������________��________��
��4��F�ĺ˴Ź���������ʾֻ��һ��壬�ݵĻ�ѧ����ʽΪ________��
��5��G�Ľṹ��ʽΪ________��
��6������˵����ȷ����________������ĸ��ţ���
a����Ϊ������Ӧ
b��B��D��Ϊͬϵ��
c��D�ķе��̼ͬԭ������������
d. 1 mol 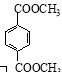 ������NaOH��Һ��Ӧʱ���������4 mol NaOH[
������NaOH��Һ��Ӧʱ���������4 mol NaOH[
��7��д����PET�����Ʊ�PET����������B�Ļ�ѧ����ʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2CO3�׳ƴ���մ�NaHCO3�׳�С�մ��������ճ������ҵ�����ж����Ź㷺��Ӧ�á�ij��ѧ��ȤС�����������ʵ����̽�����ߵ�ijЩ���ʡ����������ѧ֪ʶ����������йص���ƺ�ʵ�顣
��1����ͬѧ�ⶨ���ߵ�����ԣ���ȡһ�����Ĺ�������ˮ�������ͬŨ�ȵ���Һ���ⶨ��pHֵ���ⶨ���ΪNa2CO3��NaHCO3��pH�ֱ�Ϊa��b��a��b������7������a b������������������������С��������
��2���й���100mL0.1 mol��L-1NaHCO3����100mL0.1 mol��L-1Na2CO3��������Һ����������ȷ��
A��NaHCO3��Һ����c (H+)+c (Na+)= c (HCO)+2c(CO)+c(OH��)
B��Na2CO3��Һ����2c (Na+)= c (HCO)+c(CO)+ c(H2CO3)
C������Һ�У�c(CO)>c(H2CO3)
D������Һ�У�c(HCO)>c(H2CO3)
��3����ͬѧȡһ������̼������Һ���Թ��У��μ�2��3�η�̪��Һ��������Һ��죬�����μ�BaCl2��Һ��Ԥ�ƿɹ۲쵽�������� �������ϱ�Ҫ�����ӷ���ʽ��Ӧ��ƽ��Ĺ۵�����й�����IJ����� ��
��4����ͬѧ��10mL0.10 mol��L��1��Na2CO3��Һ����εμ�0.10 mol��L��1��HCl������Һ�еģ�c(Na+)=c(Cl��)+c(HCO)+2c(CO)����ʱ��Һ�� ����������������������������������������HCl�����
10mL��������������������������������
��5����֪��Ksp��CaCO3��=4.96��10-9����������������Ӱ�죬�ֽ�0.40 mol��L��1��Na2CO3��Һ��0.20 mol��L��1��CaCl2��Һ�������ϣ����Ϻ���Һ��Ca2+Ũ��Ϊ mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��5���л���ѧ������(15��)�����㶹����һ����������Ѫ�ܼ�����ҩ����谭Ѫ˨��չ����ṹ��ʽΪ�� �������㶹�ؿ���ͨ�����·����ϳ�(���ַ�Ӧ����ʡ��)��
�������㶹�ؿ���ͨ�����·����ϳ�(���ַ�Ӧ����ʡ��)��

��֪�� + H2O
+ H2O
�ش��������⣺
��1����Ӧ�ٵķ�Ӧ������ ����A��B����Ĺ����������� ��
��2����Ӧ�ڵ������� ��
��3����Ӧ�۵Ļ�ѧ����ʽΪ ��
��4������E���ʣ�����˵����ȷ���� (����ĸ���)��
a���ں˴Ź������������������շ�
b�����������Ը��������Һ����D��E
c�����Է����ӳɷ�Ӧ���ۺϷ�Ӧ��������Ӧ�ͻ�ԭ��Ӧ
d������˳���칹
��5��д��G�Ľṹ��ʽ ��
��6�����ӽṹ��ֻ����һ��������ͬʱ��������������G��ͬ���칹�干�� �֡�
�ٿ����Ȼ�����Һ������ɫ��Ӧ�� �ڿ���̼��������Һ��Ӧ���ɶ�����̼���塣
���У������ϵ�һ�ȴ���ֻ�����ֵ�ͬ���칹��Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E 5��Ԫ�أ����ǵĺ˵�������������Ҷ�С��20������C��E�ǽ���Ԫ�أ�A��E��ͬһ�壬����ԭ�ӵ����������Ų�Ϊns1��B��DҲ��ͬһ�壬����ԭ��������p�ܼ���������s�ܼ���������������Cԭ��������ϵ���������Dԭ��������ϵ�������һ�롣��ش��������⣺
��1����������Ԫ����ɵ�һ�ֻ������ǣ�д��ѧʽ��________________________��
��2��д��CԪ�ػ�̬ԭ�ӵĵ����Ų�ʽ_________________________��
��3���ù����ʾʽ��ʾDԪ��ԭ�ӵļ۵��ӹ���____________________��
��4��Ԫ��B��D�ĵ縺�ԵĴ�С��ϵ��___________��C��E�ĵ�һ�����ܵĴ�С��ϵ��___________������������������������Ԫ�ط��ű�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z���ֶ�����Ԫ�أ����ǵ�ԭ������֮��Ϊ16 ��X��Y��Z����Ԫ�س��������ڳ����¶�����ɫ���壬���ʵ������¿ɷ�������ͼ��ʾ�仯��

��֪һ��B�����к��е�ZԪ�ص�ԭ�Ӹ�����C�����е���һ����
��ش��������⣺
��1��XԪ�������ڱ��е�λ����______________________��
��2��X�ĵ�����Z�ĵ��ʿ��Ƴ����͵Ļ�ѧ��Դ��KOH��Һ���������Һ���������缫���ɶ����̼�Ƴɣ�ͨ��������ɿ�϶���ݳ������ڵ缫����ŵ磬������ͨ��__________�����������ƣ��������缫��ӦʽΪ____________________��
��3��C��һ�������·�Ӧ����A�Ļ�ѧ����ʽ��_______________________________��
��4����֪Y�ĵ�����Z�ĵ�������C�ķ�Ӧ�ǿ��淴Ӧ����H��0���������ʵ�����Y��Z�ĵ��ʳ���һ�ܱ������У����ʵ������ͺ��¡���ѹ�����·�Ӧ������˵���У���ȷ����____________________����д���и������ţ���
a���ﵽ��ѧƽ��ʱ������Ӧ�������淴Ӧ�������
b����Ӧ�����У�Y�ĵ��ʵ��������ʼ��Ϊ50%
c���ﵽ��ѧƽ��ʱ��Y��Z�����ֵ����ڻ�������е����ʵ���֮��Ϊ1:1
d���ﵽ��ѧƽ��Ĺ����У��������ƽ����Է���������С
e���ﵽ��ѧƽ����������¶ȣ�C�������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com