
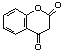
����Ŀ������ѧ����ѡ��5���л���ѧ������(15��)�����㶹����һ����������Ѫ�ܼ�����ҩ����谭Ѫ˨��չ����ṹ��ʽΪ�� �������㶹�ؿ���ͨ�����·����ϳ�(���ַ�Ӧ����ʡ��)��
�������㶹�ؿ���ͨ�����·����ϳ�(���ַ�Ӧ����ʡ��)��

��֪�� + H2O
+ H2O
�ش��������⣺
��1����Ӧ�ٵķ�Ӧ������ ����A��B����Ĺ����������� ��
��2����Ӧ�ڵ������� ��
��3����Ӧ�۵Ļ�ѧ����ʽΪ ��
��4������E���ʣ�����˵����ȷ���� (����ĸ���)��
a���ں˴Ź������������������շ�
b�����������Ը��������Һ����D��E
c�����Է����ӳɷ�Ӧ���ۺϷ�Ӧ��������Ӧ�ͻ�ԭ��Ӧ
d������˳���칹
��5��д��G�Ľṹ��ʽ ��
��6�����ӽṹ��ֻ����һ��������ͬʱ��������������G��ͬ���칹�干�� �֡�
�ٿ����Ȼ�����Һ������ɫ��Ӧ�� �ڿ���̼��������Һ��Ӧ���ɶ�����̼���塣
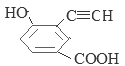
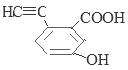
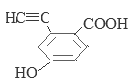
���У������ϵ�һ�ȴ���ֻ�����ֵ�ͬ���칹��Ľṹ��ʽΪ ��
������(1)ȡ����Ӧ(��������Ӧ)(1��)����ԭ��(1��) (2)����������Һ������
(3) (3��) (4) cd
(3��) (4) cd
(5)  (6)13��
(6)13�� 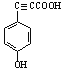
��������
���������![]() ��Ũ���ᡢŨ�����ڼ���ʱ����ȡ����Ӧ����A:�������ױ�
��Ũ���ᡢŨ�����ڼ���ʱ����ȡ����Ӧ����A:�������ױ�![]() ��A��Br2�ڹ���ʱ����ȡ����Ӧ����B:
��A��Br2�ڹ���ʱ����ȡ����Ӧ����B:![]() ��B��NaOH��ˮ��Һ����ȡ����Ӧ������Է���������153��C��
��B��NaOH��ˮ��Һ����ȡ����Ӧ������Է���������153��C��![]() ��C������ΪD��
��C������ΪD��![]() ��D��
��D��![]() ������Ӧ����E:
������Ӧ����E:![]() ������
������![]() ���������������Ӧ����G��
���������������Ӧ����G��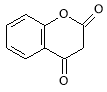 ��G��E������Ӧ�γ�
��G��E������Ӧ�γ�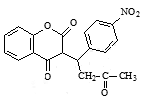 ��
��
��1���������Ϸ�����֪��Ӧ���ķ�Ӧ������ȡ����Ӧ����A��B����ȡ����Ӧ������Ĺ�������������ԭ�ӣ�
��2����Ӧ����±������ˮ�ⷴӦ����Ӧ������������������Һ�����ȡ�
��3��![]() ��
��![]() ������Ӧ�۲���
������Ӧ�۲���![]() �Ļ�ѧ����ʽΪ
�Ļ�ѧ����ʽΪ
 ��
��
��4������E��![]() ����a�������ʷ����к������в�ͬ����ԭ�ӣ����Ժ˴Ź������������������շ壬a����b������D�к���ȩ��������E�к��е�̼̼˫�������Ա�����KMnO4��Һ��������˲��������Ը��������Һ����D��E��b����c������E�к���̼̼˫�����ʻ����Է����ӳɷ�Ӧ��̼̼˫�����Է����ӳɾۺϷ�Ӧ��������Ӧ�ͻ�ԭ��Ӧ��c��ȷ��d�������ڲ����͵�̼̼˫�������в�ͬ��ԭ�ӻ�ԭ���ţ����ǿ�����˫����ͬ�࣬Ҳ����˫������࣬�ʴ���˳���칹��d��ȷ����ѡcd��
����a�������ʷ����к������в�ͬ����ԭ�ӣ����Ժ˴Ź������������������շ壬a����b������D�к���ȩ��������E�к��е�̼̼˫�������Ա�����KMnO4��Һ��������˲��������Ը��������Һ����D��E��b����c������E�к���̼̼˫�����ʻ����Է����ӳɷ�Ӧ��̼̼˫�����Է����ӳɾۺϷ�Ӧ��������Ӧ�ͻ�ԭ��Ӧ��c��ȷ��d�������ڲ����͵�̼̼˫�������в�ͬ��ԭ�ӻ�ԭ���ţ����ǿ�����˫����ͬ�࣬Ҳ����˫������࣬�ʴ���˳���칹��d��ȷ����ѡcd��
��5�����ݷ�Ӧ����������Ľṹ��֪����G�Ľṹ��ʽ��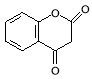 ��
��
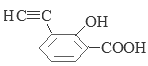
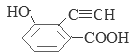
��6�����ӽṹ��ֻ����һ��������ͬʱ���������ٿ����Ȼ�����Һ������ɫ��Ӧ��˵�������к��з��ǻ����ڿ���̼��������Һ��Ӧ���ɶ�����̼����˵�������к����Ȼ���G��ͬ���칹��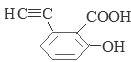 ��
�� ��
�� ��
�� ��
�� ��
�� ��
��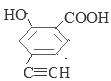 ��
�� ��
�� ��
��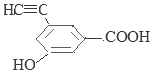 ��
��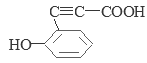 ��
��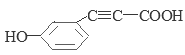 ��
��![]() ����13�֡����У������ϵ�һ�ȴ���ֻ�����ֵ�ͬ���칹��Ľṹ��ʽΪ
����13�֡����У������ϵ�һ�ȴ���ֻ�����ֵ�ͬ���칹��Ľṹ��ʽΪ![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ��ԭ���ԭ�������˶��ֵ�������㲻ͬ����Ҫ����ط�����Խ��Խ��Ҫ�����ã���������ɴ����������ǡ����ԡ�������ȣ����벻����ʽ�����ĵ�أ�ͬʱ�����ĵ����㶪��Ҳ��Ի��������Ⱦ������������ṩ����Ϣ���ش��������⣺
��1���о���Ա���������һ����ˮ����أ����ֵ�������õ�ˮ�뺣ˮ֮�京�����IJ����з��磬�ں�ˮ�е�ط�Ӧ�ɱ�ʾΪ��5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl
���õ�صĸ�����Ӧʽ��______________��
���ڵ���У�Na+�����ƶ�����ˮ����ص�_______��(����������������)��
�����·ÿͨ��4mol����ʱ������Na2Mn5O10�����ʵ�����______________��
��2���й���ѧԺӦ�û�ѧ�о����ڼ״�(CH3OH��һ�ֿ�ȼ��)ȼ�ϵ�ؼ�����������ͻ�ơ��״�ȼ�ϵ�صĹ���ԭ������ͼ��ʾ��

���õ�ع���ʱ��b��ͨ�������Ϊ______________��
���õ�ظ����ĵ缫��Ӧʽ______________��
������һ��ʱ���6.4g�״���ȫ��Ӧ����CO2ʱ����___________NA������ת�ơ�
��3��Ag2O2����п���Ե�ص������������ʣ�����п���Ե�صĵ������ҺΪKOH��Һ����طŵ�ʱ������Ag2O2ת��ΪAg��������Znת��ΪK2Zn(OH)4��д���õ�ط�Ӧ����ʽ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Īɳ������һ����ʹҩ�����ĺϳ�·�����£�
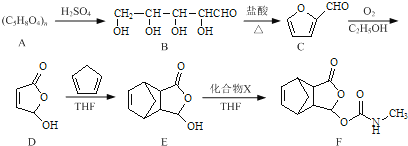
��1��B������̼ԭ����Ϊ____________��������D�к��������ŵ�����Ϊ____________��
��2��C������������ͭ��Ӧ�Ļ�ѧ����ʽΪ____________��
��3��д��ͬʱ��������������E��һ��ͬ���칹��Ľṹ��ʽ��____________
I���˴Ź���������4���壻
�����ܷ���������Ӧ��ˮ�ⷴӦ��
��������FeCl3��Һ������ɫ��Ӧ��
��4����֪E+X��FΪ�ӳɷ�Ӧ��������X�Ľṹ��ʽΪ____________��
��5����֪��![]() ��������
�������� �Ǻϳɿ�����ҩ������Τ���м��壬����ƺ���������
�Ǻϳɿ�����ҩ������Τ���м��壬����ƺ���������![]() ��
��![]() Ϊԭ�Ϻϳɸû�����(�úϳ�·������ͼ��ʾ����ע����Ӧ����)���ϳ�·������ͼʾ�����£�
Ϊԭ�Ϻϳɸû�����(�úϳ�·������ͼ��ʾ����ע����Ӧ����)���ϳ�·������ͼʾ�����£�![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�ϳ������з����Ʊ�H2��
�����٣�C��s��+2H2O��g��![]() CO2��g��+2H2��g��
CO2��g��+2H2��g��
�����ڣ�CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
��1����֪��C��ʯī��+O2��g���TCO2��g����H=-394kJmol-1
��2C��ʯī��+O2��g���T2CO2��g����H=-222kJmol-1
��2H2��g��+O2��g���T2H2O��g����H=-484kJmol-1
�Լ���25��ʱ�ɷ������Ʊ�1000gH2���ų�������Ϊ______kJ��
��2����һ���������£���C��s����H2O��g���ֱ����ס��������ܱ�������������Ӧ��C��s��+2H2O��g��![]() CO2��g��+2H2��g��������������±���ʾ��
CO2��g��+2H2��g��������������±���ʾ��

��T1______T2�����������=����������T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=______��
���������У�����Ӧ���е�1.5minʱ��H2O��g�������ʵ���Ũ�ȷ�Χ��______��
�����ܱպ��ݵ������У��ܱ�ʾ������Ӧ�ﵽ��ѧƽ��״̬����______��
A��V�棨CO2��=2V����H2��
B�����������ܶȱ��ֲ���
C��c��H2O����c��CO2����c��H2��=2��1��2
D����������ƽ��Ħ���������ֲ���
��ijͬѧΪ���о���Ӧ�����Ի�ѧƽ���Ӱ�죬����淴Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��

��t1��t3��t5��t7ʱ��Ӧ�����˵�ƽ��״̬�����t2��t4��t6��t8ʱ��ֻ�ı���һ����Ӧ��������t6ʱ�̸ı��������________________________����t1��t8�ĸ�ʱ���H2O��g����ƽ��ת�������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���飨As���ǵ������ڵ�VA��Ԫ�أ�������Ȼ���еĺ������ߣ���������ʶ�����о�������ʷȴ�ܳ���
(1)��֪H3AsO3������ƫ���ԵĻ����H3AsO3��As�Ļ��ϼ�Ϊ_____�������������ᷴӦʱ�����εĻ�ѧʽΪ_______________��Na2HAsO3��Һ�ʼ��ԣ�ԭ����_________________�������ӷ���ʽ��ʾ��������Һ��c��H2AsO3-�� _____c��AsO33-�����>������<����=������
��2��������Ȼ������Ҫ��������ʽ�����ۻ�As4S4���ƻ�As2S3�ȣ����ڡ�
�ٹ�ҵ�����ۻ�Ϊԭ���Ʊ��顢������˪��As2O3����ԭ������ͼ��

��Ӧa�����ķ���ֱ���ŷſ��ܴ����Ļ���������__________ _____����д����Ӧb�Ļ�ѧ����ʽ��_________________________��
�ڴƻƿɱ�Ũ��������ΪH3AsO4��S�����ᱻ��ԭΪNO2����Ӧ�л�ԭ�������������ʵ���֮��Ϊ_________��
����c��As3+��=0.01mol/L�Ĺ�ҵ��ˮ�м���FeS����������ǡ����ȫ��ȥ��С��1��10-5mol/L�������ʱc��Fe2+��=_____mol/L������֪Ksp��As2S3��=1��10-22��Ksp��FeS��=6��10-18��
��3��ijԭ���װ������ͼ������ܷ�ӦΪAsO43-+2I��+H2O![]() AsO33-+I2+2OH����P������Һ����ɫ�����ɫʱ�������ϵĵ缫��ӦʽΪ_______________����������ָ����к���Q���м���һ������NaOH���������_____���P����Q������������
AsO33-+I2+2OH����P������Һ����ɫ�����ɫʱ�������ϵĵ缫��ӦʽΪ_______________����������ָ����к���Q���м���һ������NaOH���������_____���P����Q������������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ�
���ʵĽṹ�������ʵ����ʡ���ش������漰���ʽṹ�����ʵ����⣺
��1���ڶ������У�Ԫ�صĵ�һ�����ܴ���B��N֮���Ԫ����_________�֡�
��2��ijԪ��λ�ڵ����������壬���̬ԭ�ӵ�δ�ɶԵ��������̬̼ԭ�ӵ�δ�ɶԵ�������ͬ�������̬ԭ�ӵļ۲�����Ų�ʽΪ_________________��
��3����ϩͪ��CH2��C��O����һ����Ҫ���л��м��壬����CH3COOH�ڣ�C2H5O��3P��O�����¼�����H2O�õ�����ϩͪ������̼ԭ���ӻ����������_____________��1mol��C2H5O��3P��O�����к��е���������ĿΪ__________________��
��4����֪��̬NH3��H2O��HF��������ܺͽṹ���£�


����H2O��HF��NH3�е����ν��͵�ԭ��___________________��
��5��̼����Ľṹ����ʯ���ƣ���Ӳ�Ƚ����ڽ��ʯ�����н�ǿ����ĥ���ܡ�̼���辧���ṹ��ÿ��̼ԭ����Χ�����������Ĺ�ԭ����___________������̼ԭ�ӵȾ��������̼ԭ����__________������֪̼���辧���߳�Ϊapm����ͼ��1�Ź�ԭ�Ӻ�2��̼ԭ��֮��ľ���Ϊ________pm��̼������ܶ�Ϊ__________g��cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���о���ѧ��ӦX+Y=Z�������仯�����ijͬѧ�������ͼ��ʾװ�á�����ʢ��X���Թ��еμ��Լ�Yʱ������U���м״�Һ���½��Ҵ�Һ���������Իش��������⣺
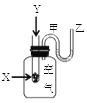
��1���÷�ӦΪ______��Ӧ��������������������������
��2��X��Y����������Z��������_______����������������������
��3�������еĻ�ѧ��ͨ��_____ת����_______�ͷų�����
��4����Ӧ�ﻯѧ���������յ�����____�������ﻯѧ���γɷų�����������������������������
��5����֪2mol������ȫȼ������ˮ����ʱ�ų�����484kJ����������1molO=O����ȫ����ʱ��������496kJ��ˮ������1molH-O���γ�ʱ�ų�����463kJ����������1molH-H������ʱ��������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����̽��Ԫ�������ɡ���ͬѧ����Ԫ�طǽ��������Ӧ��ۺ�����֮��Ĺ�ϵ���������ͼ1װ����һ�������N��C��Si���ַǽ���Ԫ�صķǽ�����ǿ���Ƚϵ�ʵ���о�����ͬѧ�������ͼ2װ������֤±��Ԫ�����ʵĵݱ���ɡ�ͼ2�У�A��B��C�����ֱ���մ��NaBr��Һ������ʪ��ĵ���KI��ֽ��ʪ���ֽ����֪������Ũ�������������ܷ�Ӧ����������MnCl2�ȡ�

��1����ͬѧʵ����ѡ�õ����ʻ�ѧʽΪ��A___________��B__________��C___________��
��2��C����Ӧ�����ӷ���ʽΪ________________________ ��
��3��д����ͬѧ��ʵ����Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽ______________________ ��
��4��A����Ӧ�����ӷ���ʽΪ_________________________��
��5��B����ʵ������Ϊ ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A�������ʵ�����O2��CO2������ԭ������Ϊ2NA
B����״���£�2.24 Lһ�ȼ����к�����ԭ����ĿΪ0.3NA
C���ڷ�ӦKIO3+6HI��KI+3I2+3H2O�У�ÿ����3mol I2ת�Ƶĵ�����Ϊ6NA
D��6.8 g���ڵ�KHSO4�к���0.1 NA��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com