
【题目】【化学——选修3:物质结构与性质】
物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_________________。
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是_____________,1mol(C2H5O)3P=O分子中含有的σ键的数目为__________________。
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:


解释H2O、HF、NH3沸点依次降低的原因___________________。
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有___________个,与碳原子等距离最近的碳原子有__________个。已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为________pm,碳化硅的密度为__________g/cm3。
【答案】(1)3 (2)3d84s2 (3)sp2和sp(2分)25NA
(4)单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n大于(NH3)n
(5)4 12 ![]()
【解析】
试题分析:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的价层电子排布式为3d84s2;
(3)在CH2=C=O中,一个碳原子的价层电子对数为![]() =3,另一个碳原子的价层电子对数为
=3,另一个碳原子的价层电子对数为![]() =2,所以碳原子的杂化轨道类型有sp2和sp;单键全是σ键、双键有一个σ键,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA;
=2,所以碳原子的杂化轨道类型有sp2和sp;单键全是σ键、双键有一个σ键,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA;
(4)单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n;
(5)碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个。已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为![]() pm;根据题图知,每个碳原子周围有4个硅原子与其距离最近且相等;该晶胞中含有的碳原子个数为个硅原子与其距离最近且相等,该晶胞中含有的碳原子个数为8×18+6×12=4,硅原子个数为4 ,则根据公式
pm;根据题图知,每个碳原子周围有4个硅原子与其距离最近且相等;该晶胞中含有的碳原子个数为个硅原子与其距离最近且相等,该晶胞中含有的碳原子个数为8×18+6×12=4,硅原子个数为4 ,则根据公式 ![]() ×ρ × NA=4×40g·mol- 1得ρ=
×ρ × NA=4×40g·mol- 1得ρ=![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的物理性质见附表)。
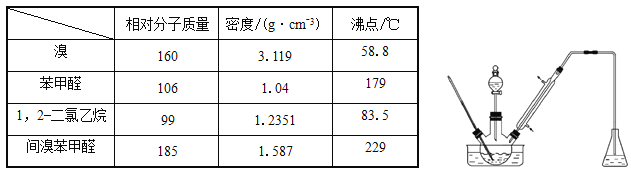
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛(5.3g)充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水硫酸钙固体,放置一段时间后过滤。
步骤4:为了防止间溴苯甲醛因温度过高被氧化,把步骤3处理得到的间溴苯甲醛加入少量锌粉,同时采用某种技术,收集相应馏分,其中收集到间溴苯甲醛为3.7g 。
(1)实验装置中采用的加热方式为_______,冷凝管的作用为_______,锥形瓶中的试剂应为________。
(2)步骤1所加入的无水AlCl3的作用为_________。
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式)。
(4)步骤3中加入的无水硫酸钙固体的目的是_______________。
(5)步骤4中,某种技术为__________________。
(6)本实验所得到的间溴苯甲醛产率是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7),则a b(填“大于”“等于”或“小于”)。
(2)有关①100mL0.1 mol·L-1NaHCO3、②100mL0.1 mol·L-1Na2CO3,两种溶液的叙述不正确是
A.NaHCO3溶液中:c (H+)+c (Na+)= c (HCO)+2c(CO)+c(OH-)
B.Na2CO3溶液中:2c (Na+)= c (HCO)+c(CO)+ c(H2CO3)
C.①溶液中:c(CO)>c(H2CO3)
D.②溶液中:c(HCO)>c(H2CO3)
(3)乙同学取一定量的碳酸钠溶液于试管中,滴加2~3滴酚酞试液,发现溶液变红,继续滴加BaCl2溶液,预计可观察到的现象是 ,请你结合必要的离子方程式,应用平衡的观点解释有关现象的产生: 。
(4)丙同学往10mL0.10 mol·L-1的Na2CO3溶液中逐滴滴加0.10 mol·L-1的HCl,当溶液中的:c(Na+)=c(Cl-)+c(HCO)+2c(CO),此时溶液呈 (填“酸性”、“中性”或“碱性”),所用HCl的体积
10mL。(填“大于”“等于”或“小于”)
(5)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40 mol·L-1的Na2CO3溶液和0.20 mol·L-1的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】(15分)醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为: 。醋硝香豆素可以通过以下方法合成(部分反应条件省略)。
。醋硝香豆素可以通过以下方法合成(部分反应条件省略)。

已知: + H2O
+ H2O
回答以下问题:
(1)反应①的反应类型是 ;从A到B引入的官能团名称是 。
(2)反应②的条件是 。
(3)反应③的化学方程式为 。
(4)关于E物质,下列说法正确的是 (填字母序号)。
a.在核磁共振氢谱中有四组吸收峰
b.可以用酸性高锰酸钾溶液鉴别D和E
c.可以发生加成反应、聚合反应、氧化反应和还原反应
d.存在顺反异构
(5)写出G的结构简式 。
(6)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有 种。
①可与氯化铁溶液发生显色反应; ②可与碳酸氢钠溶液反应生成二氧化碳气体。
其中,苯环上的一氯代物只有两种的同分异构体的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下列实验,来研究硫酸和硝酸的性质。

实验一:在一支试管中放入一块很小的铜片,再加入2 mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。待试管中的液体冷却后,将试管中的液体慢慢倒入另一支盛有少量水的试管中,观察现象。
回答下列问题:
(1)a处反应的化学方程式为________________________________,计算放出112 mL气体(标准状况),转移电子的物质的量为________________。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为________________________。
待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为__________________________________________________________________。
实验二:为了证明铜与稀硝酸反应产生一氧化氮,某同学设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去)。A为注射器,B为两端长短不等的U形管,C是装有NaOH溶液的烧杯,D处是绕成螺旋状的铜丝,K1、K2是止水夹。

(1)实验时,为在D处收集到NO,以便观察颜色,必须事先在A中吸入一定量的空气。然后__________K1(“关闭”或“打开”),从U形管左端注入稀硝酸,当看到________________________现象可以确定U形管中空气已被赶尽。
(2)然后给装置B微微加热,在装置D处产生无色气体,其反应的离子方程式为:
________________________________________________________________________。
(3)如何证明D处聚集的是NO而不是H2?
________________________________________________________________________。
(4)实验现象观察完毕,关闭止水夹K1,打开止水夹K2,在重力作用下,U形管右端的红棕色混合气体被酸液压入NaOH溶液中吸收,消除了环境污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)由这五种元素组成的一种化合物是(写化学式)________________________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)用轨道表示式表示D元素原子的价电子构型____________________。
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填﹥、﹤、﹦,并且用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学—选修3:物质结构与性质)
氮化硼(BN)被称为一种“宇宙时代的材料”,具有很大的硬度。
(1)基态硼原子有__________个未成对电子,氮离子的电子排布式为__________。
(2)部分硼的化合物有以下转化:![]()
则下列叙述正确的是__________(填序号);
A.B3N3H6俗称无机苯,但不是平面分子
B.BNH6与乙烷是等电子体
C.HB≡NH中的硼原子、氮原子韵杂化类型相同
D.硼、氮、氧三元素的第一电离能比较:B<N<O
(3)下图的晶体结构中,黑球白球分别代表不同的原子、离子或分子,则图1的晶胞中含有的粒子总数为__________;图2中的白球的配位数是__________。

(4)已知图3、4均表示BN晶体的结构,制备氮化硼的原理为:BCl3+2NH3=BN+2HCl+NH4Cl,当该反应中有1mol BN生成时,则反应中可形成__________mol配位键,比较氮化硼晶体与晶体硅的沸点高低并解释原因____________________。
(5)X射线的衍射实验可获取晶体的结构,包括晶胞形状、大小及原子的分布等参数,从而提供了又一种实验测定阿伏加德罗常数和元素的相对质量的方法。若图4晶胞的棱长为a nm,密度为ρ g·cm-3,则阿伏加德罗常数为__________(要求化为最简关系)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1 = a kJmol-1
CO(g) + H2O (g)=CO2(g) + H2 (g) ΔH2 = b kJmol-1
2CO(g) + O2(g)=2CO2(g) ΔH3 = c kJmol-1
反应CO2(g) + CH4(g)![]() 2CO(g) + 2H2(g) 的ΔH= kJmol-1。
2CO(g) + 2H2(g) 的ΔH= kJmol-1。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。

① 在不同温度下催化剂的催化效率与乙酸的生成速率如图8所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
② 为了提高该反应中CH4的转化率,可以采取的措施是 。
③ 将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)以CO2为原料可以合成多种物质。
① 利用FeO吸收CO2的化学方程式为:6FeO + CO2=2Fe3O4 + C,则反应中每生成1molFe3O4,转移电子的物质的量为 mol。
② 以氢氧化钾水溶液作电解质进行电解,在铜电极上CO2可转化为CH4,另一电极石墨连接电源的 极,则该电解反应的化学方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com