
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)由这五种元素组成的一种化合物是(写化学式)________________________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)用轨道表示式表示D元素原子的价电子构型____________________。
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填﹥、﹤、﹦,并且用元素符号表示)
【答案】(1)KAl(SO4)212H2O(2)1s22s22p63s23p1(3) (4)O>S;Al>K
(4)O>S;Al>K
【解析】试题分析:A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20,B和D属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,故最外层电子排布为ns2np4,故B为O元素,D为S元素,A和E元素原子的最外层电子排布为ns1,处于第ⅠA族,E为金属,E的原子序数大于S元素,故A为H元素,E为K元素,C原子最外层上电子数等于D原子最外层上电子数的一半,故C原子最外层电子数为3,原子序数介于O与S之间,故C为Al元素。
(1)由这五种元素组成的一种化合物是KAl(SO4)212H2O。
故答案为:KAl(SO4)212H2O;
(2)C为Al原子,基态Al原子的电子排布式为:1s22s22p63s23p1。
故答案为:1s22s22p63s23p1;
(3)D为S元素,原子价层电子排布为ns2np4,轨道表示式为 。
。
故答案为: ;
;
(4)同主族自上而下电负性降低,故电负性O>S,金属性越强,第一电离能越小,故第一电离能Al>
K。 故答案为:O>S;Al>K


科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为___________________;
(2)已知:①E-E→2E;△H=+a kJmol-1
②2A→A-A;△H=-b kJmol-1
③E+A→A-E;△H=-c kJmol-1(“”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式___________________;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)X(g);△H=-d Jmol-1(d>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2mol A2、1mol BC | 1mol X | 4mol A2、2mol BC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①该温度下此反应的平衡常数K的值为_____;
②三个容器中的反应分别达平衡时各组数据关系正确的是_____(填序号)
A.α1+α2=1 B.α3<α1 C.n2<n3<1.0mol D.P3<2P1=2P2 E.Q1+Q2=d F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min到新平衡时X的物质的量浓度的变化曲线。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业上常用下列方法制备H2:
方法①:C(s)+2H2O(g)![]() CO2(g)+2H2(g)
CO2(g)+2H2(g)
方法②:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJmol-1
②2C(石墨)+O2(g)═2CO2(g)△H=-222kJmol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJmol-1
试计算25℃时由方法②制备1000gH2所放出的能量为______kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:

①T1______T2(填“>”、“=”或“<”);T1℃时,该反应的平衡常数K=______。
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是______。
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是______。
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是________________________,从t1到t8哪个时间段H2O(g)的平衡转化率最低______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
物质的结构决定物质的性质。请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有_________种。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_________________。
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到。乙烯酮分子中碳原子杂化轨道类型是_____________,1mol(C2H5O)3P=O分子中含有的σ键的数目为__________________。
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:


解释H2O、HF、NH3沸点依次降低的原因___________________。
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有___________个,与碳原子等距离最近的碳原子有__________个。已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为________pm,碳化硅的密度为__________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应X+Y=Z的能量变化情况,某同学设计了如图所示装置。当向盛有X的试管中滴加试剂Y时,看到U型管中甲处液面下降乙处液面上升。试回答下列问题:
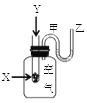
(1)该反应为______反应(填“放热”或“吸热”)。
(2)X和Y的总能量比Z的总能量_______(填“高”或“低”)。
(3)物质中的化学能通过_____转化成_______释放出来。
(4)反应物化学键断裂吸收的能量____于生成物化学键形成放出的能量(填“高”或“低”)。
(5)己知2mol氢气完全燃烧生成水蒸气时放出能量484kJ,且氧气中1molO=O键完全断裂时吸收能量496kJ,水蒸气中1molH-O键形成时放出能量463kJ,则氢气中1molH-H键断裂时吸收能量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)y在元素周期表中的位置是_______。z、d、e、f四种元素的简单离子中,半径最小的是______(填离子符号)。
(2)g和h氢化物的稳定性由大到小的顺序:_______(用化学式表示)。
(3)元素e和g的同族元素中半径最小元素组成的化合物B中离子半径较大的是______(填离子符号)。
(4)下列可作为比较f和Na随金属性强弱的依据是____。(填序号)
a.测两种元素单质的硬度和熔、沸点
b.比较两元素最高价氧化物对应的水化物溶液的碱(或酸)性强弱
c.比较两种元素在氯化物中化合价的高低
d.比较单质与同浓度盐酸反应的剧烈程度
(5)有人建议将氢元素排在元素周期表的IVA族,请你从化合价的角度给出一个理由_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气和MnCl2等。

(1)甲同学实验中选用的物质化学式为:A___________,B__________,C___________;
(2)C处反应的离子方程式为________________________ ;
(3)写出乙同学的实验中圆底烧瓶中发生反应的化学方程式______________________ ;
(4)A处反应的离子方程式为_________________________;
(5)B处的实验现象为 ___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学---选修2:化学与技术】水是生命之源,水的品质对于健康有着十分重要的意义。化学兴趣小组对某山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于 硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加时先加 后加 ,原因是 。
(3)目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂则水中的Ca2+、Mg2+与交换树脂的 起离子交换作用。若使用NaR作为阳离子交换树脂失效后可放入5%-8% 溶液中再生。
(4)海水淡化是获得淡水的重要来源。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、S![]() 等离子,电极为惰性电极。请分析下列问题:
等离子,电极为惰性电极。请分析下列问题:

①阳离子交换膜是指 (填A或B)。
②写出通电后阳极区的电极反应式 。阴极区的现象是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+1/2O2(g)![]() CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______

A.CH3OH转变成H2的过程是一个吸收能量的过程
B.H2的生成速率与CH3OH的消耗速率之比为1:2
C.化学变化不仅有新物质生成,同时也一定有能量变化
D.1 mol H—O键断裂的同时2 mol C=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速度v(H2)= ,则CH3OH的转化率为 。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。则下列说法正确的是 。
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-==CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2 mol电子
(4)写出甲醇燃料电池在酸性条件下负极的反应式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com