
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)y在元素周期表中的位置是_______。z、d、e、f四种元素的简单离子中,半径最小的是______(填离子符号)。
(2)g和h氢化物的稳定性由大到小的顺序:_______(用化学式表示)。
(3)元素e和g的同族元素中半径最小元素组成的化合物B中离子半径较大的是______(填离子符号)。
(4)下列可作为比较f和Na随金属性强弱的依据是____。(填序号)
a.测两种元素单质的硬度和熔、沸点
b.比较两元素最高价氧化物对应的水化物溶液的碱(或酸)性强弱
c.比较两种元素在氯化物中化合价的高低
d.比较单质与同浓度盐酸反应的剧烈程度
(5)有人建议将氢元素排在元素周期表的IVA族,请你从化合价的角度给出一个理由_______。
【答案】(1)第二周期第IVA族,Al3+;(2)HCl,H2S;(3)O2-;(4)bd;
(5)氢元素的最高正价和最低负价的绝对值相等。
【解析】试题分析:从图中的化合价、原子半径的大小及原子序数可知:x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素。(1)y是C元素,其原子序数为6,在元素周期表中位于第二周期IVA族;(2)g是S元素,h是Cl元素,由于元素的非金属性S<Cl,元素的非金属性越强,其相应的氢化物的稳定性就越强,所以g和h氢化物的稳定性由大到小的顺序是HCl>H2S;(3)e是Na元素,g是S元素,其同族的短周期元素的O元素,它们形成的离子核外电子排布是2、8电子层结构,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+;(4) f是Al元素,与Na元素是同一周期的元素,元素的金属性越强,其相应的最高价氧化物对应的水化物溶液的碱性越强,单质与水或酸置换出氢气就越容易,与其单质的硬度大小及元素在化合物中的化合价及单质失去电子的多少无关,故选项bd符合题意;(5)有人建议将氢元素排在元素周期表的IVA族,是由于该元素的原子最外层只有一个电子,氢元素的最高正价和最低负价的绝对值相等。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:
。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g) △H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10—16,K稳[Ag(CN)2—]=1.0×10-21,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]()
![]() N2O4其相关图像如下。
N2O4其相关图像如下。

①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7),则a b(填“大于”“等于”或“小于”)。
(2)有关①100mL0.1 mol·L-1NaHCO3、②100mL0.1 mol·L-1Na2CO3,两种溶液的叙述不正确是
A.NaHCO3溶液中:c (H+)+c (Na+)= c (HCO)+2c(CO)+c(OH-)
B.Na2CO3溶液中:2c (Na+)= c (HCO)+c(CO)+ c(H2CO3)
C.①溶液中:c(CO)>c(H2CO3)
D.②溶液中:c(HCO)>c(H2CO3)
(3)乙同学取一定量的碳酸钠溶液于试管中,滴加2~3滴酚酞试液,发现溶液变红,继续滴加BaCl2溶液,预计可观察到的现象是 ,请你结合必要的离子方程式,应用平衡的观点解释有关现象的产生: 。
(4)丙同学往10mL0.10 mol·L-1的Na2CO3溶液中逐滴滴加0.10 mol·L-1的HCl,当溶液中的:c(Na+)=c(Cl-)+c(HCO)+2c(CO),此时溶液呈 (填“酸性”、“中性”或“碱性”),所用HCl的体积
10mL。(填“大于”“等于”或“小于”)
(5)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40 mol·L-1的Na2CO3溶液和0.20 mol·L-1的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下列实验,来研究硫酸和硝酸的性质。

实验一:在一支试管中放入一块很小的铜片,再加入2 mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。待试管中的液体冷却后,将试管中的液体慢慢倒入另一支盛有少量水的试管中,观察现象。
回答下列问题:
(1)a处反应的化学方程式为________________________________,计算放出112 mL气体(标准状况),转移电子的物质的量为________________。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为________________________。
待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为__________________________________________________________________。
实验二:为了证明铜与稀硝酸反应产生一氧化氮,某同学设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去)。A为注射器,B为两端长短不等的U形管,C是装有NaOH溶液的烧杯,D处是绕成螺旋状的铜丝,K1、K2是止水夹。

(1)实验时,为在D处收集到NO,以便观察颜色,必须事先在A中吸入一定量的空气。然后__________K1(“关闭”或“打开”),从U形管左端注入稀硝酸,当看到________________________现象可以确定U形管中空气已被赶尽。
(2)然后给装置B微微加热,在装置D处产生无色气体,其反应的离子方程式为:
________________________________________________________________________。
(3)如何证明D处聚集的是NO而不是H2?
________________________________________________________________________。
(4)实验现象观察完毕,关闭止水夹K1,打开止水夹K2,在重力作用下,U形管右端的红棕色混合气体被酸液压入NaOH溶液中吸收,消除了环境污染。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)由这五种元素组成的一种化合物是(写化学式)________________________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)用轨道表示式表示D元素原子的价电子构型____________________。
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填﹥、﹤、﹦,并且用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】IA、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构。

(1)试判断A、B、C、D四种元素的名称。A______,B_____,C______,D______。
(2)C在周期表中的位置是 。
(3)由B、D两种元素组成的D2B2型化合物的电子式为_______,CB2的电子式 为________。
(4)如右图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到_____,原因是_____________。
II(9分)下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族K] | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | [m] | ⑩ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: 。
(2)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______(要求用离子符号表示)。
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学—选修3:物质结构与性质)
氮化硼(BN)被称为一种“宇宙时代的材料”,具有很大的硬度。
(1)基态硼原子有__________个未成对电子,氮离子的电子排布式为__________。
(2)部分硼的化合物有以下转化:![]()
则下列叙述正确的是__________(填序号);
A.B3N3H6俗称无机苯,但不是平面分子
B.BNH6与乙烷是等电子体
C.HB≡NH中的硼原子、氮原子韵杂化类型相同
D.硼、氮、氧三元素的第一电离能比较:B<N<O
(3)下图的晶体结构中,黑球白球分别代表不同的原子、离子或分子,则图1的晶胞中含有的粒子总数为__________;图2中的白球的配位数是__________。

(4)已知图3、4均表示BN晶体的结构,制备氮化硼的原理为:BCl3+2NH3=BN+2HCl+NH4Cl,当该反应中有1mol BN生成时,则反应中可形成__________mol配位键,比较氮化硼晶体与晶体硅的沸点高低并解释原因____________________。
(5)X射线的衍射实验可获取晶体的结构,包括晶胞形状、大小及原子的分布等参数,从而提供了又一种实验测定阿伏加德罗常数和元素的相对质量的方法。若图4晶胞的棱长为a nm,密度为ρ g·cm-3,则阿伏加德罗常数为__________(要求化为最简关系)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】
在电解冶练铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
(1)冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在__________(填序号).
a.离子键 b.极性键 c.配位键 d.范德华力
(2)CO2分子的空间构型为__________,中心原子的杂化方式为__________,和CO2 互为等电子体的氧化物是__________;
(3)反应物中电负性最大的元素为_________(填元素符号),写出其原子最外层的电子排布图__________;
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是______(填具体的微粒符号).
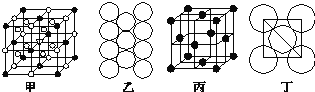
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
若已知Al的原子半径为d cm,NA代表阿伏伽德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为_________个;Al晶体的密度为__________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应速率有重要的意义。对于2A(g)+B(g)![]() 3C(g)+4D(g),
3C(g)+4D(g),
下列反应速率最快的是( )
A.vB= 0.3 mol·L-1·min-1 B.vA= 0.5 mol·L-1·min-1
C.vC= 0.8 mol·L-1·min-1 D.vD= 1 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com