
【题目】醋酸亚铬水合物{[Cr(CH3COO)2]22H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下: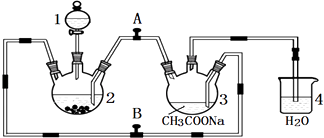
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)
请回答下列问题:
(1)仪器1的名称是 .
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是(选下面的A、B或C);目的是 . A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门(填“A”或“B”,下同),打开阀门 .
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是 .
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]22H2O 9.48g,则该实验所得产品的产率为(不考虑溶解的醋酸亚铬水合物).
【答案】
(1)分液漏斗
(2)C;让锌粒与盐酸先反应产生H2 , 把装置2和3中的空气赶出,避免生成的亚铬离子被氧化
(3)B;A
(4)使锌与CrCl3充分反应得到CrCl2
(5)84.0%
【解析】解:(1)根据仪器结构特征,可知仪器1为分液漏斗,所以答案是:分液漏斗;(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2 , 让锌粒与盐酸先反应产生H2 , 把装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,
所以答案是:C;让锌粒与盐酸先反应产生H2 , 把装置2和3中的空气赶出,避免生成的亚铬离子被氧化;(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A,
所以答案是:B;A;(4)锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是:过量的锌与CrCl3充分反应得到CrCl2 ,
所以答案是:使锌与CrCl3充分反应得到CrCl2;(5)CrCl3为 ![]() =0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,则得到[Cr(CH3COO)2]22H2O为0.06mol×
=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,则得到[Cr(CH3COO)2]22H2O为0.06mol× ![]() ×376g/mol=11.28g,
×376g/mol=11.28g,
所得产品的产率为: ![]() ×100%=84.0%,
×100%=84.0%,
所以答案是:84.0%.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室从干海带中提取碘的操作过程中,仪器选用错误的是
A. 灼烧干海带﹣﹣坩埚
B. 过滤海带灰悬浊液﹣﹣长颈漏斗
C. 从碘水中萃取碘﹣﹣分液漏斗
D. 分离碘和四氯化碳﹣﹣蒸馏烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中发生某化学反应2A(g)B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B,C的起始浓度都为0,反应物A的浓度(molL﹣1)随时间(min)的变化如图所示,请回答: 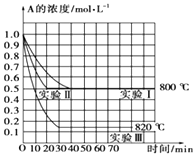
(1)在实验Ⅰ中,反应在0至40min内A的平均反应速率为molL﹣1min﹣1 .
(2)实验Ⅱ和实验Ⅰ的比较,可能隐含的反应条件是
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应升高温度,平衡向(填“正”或“逆”)反应方向移动,该正反应是(填“放热”或“吸热”)反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1mol SO2的质量是64g/mol
B. 2mol O2的摩尔质量是64g/mol
C. 当摩尔质量以g·mol-1为单位时,在数值上与阿伏加德罗常数个该物质的微粒的质量总和相等(质量以g为单位)
D. 1mol SO2中含有2mol氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( ) 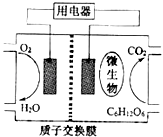
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O﹣24e﹣═6CO2+24H+
C.放电过程中,质子(H+)从负极区向正极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物的研发与绿色反展、经济可持续发展有着密切关联.
(1)氨是一种重要化工原料.合成氨原料气H2 , 可用天然气为原料制得,有关反应能量变化如图1所示.则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:
(2)氮的氧化物有着广泛用途,又是环境的污染物.(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如下表:
时间/S | 0 | 20 | 40 | 60 | 80 |
N(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
N(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①当反应在150℃达到平衡时,该反应平衡常数K= . (填数值)
②若最初通入N2O4 , 在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度
应为 .
(ii)氨氧化制HNO3的尾气中含有NO和NO2 , 且n(NO):n(NO2)=1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素[CO( NH2)2]反应生成对环境无污
染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)图2表示合成塔中氨碳比a与CO2转化率ω的关系.a为[n(NH3):n(CO2)],b为水碳比[n(H2O):n(CO2)].则:
①b应控制在;
A.1.5~1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A为原料合成重要精细化工中间体TMBA( 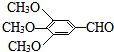 )和抗癫痫药物H(
)和抗癫痫药物H( 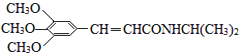 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂): 
已知:I.RONa+R′X→ROR′+NaX;
II.RCHO+R′CH2CHO ![]()
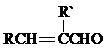 +H2O(R、R′表示烃基或氢)
+H2O(R、R′表示烃基或氢)
(1)A的名称是;C能发生银镜反应,则C分子中含氧官能团的名称是 .
(2)①和②的反应类型分别是、 .
(3)E的结构简式是 , 试剂a的分子式是 .
(4)C→D的化学方程式是 .
(5)D的同分异构体有多种,其中属于芳香族酯类化合物的共有种.
(6)F与新制Cu(OH)2悬浊液发生反应的化学方程式是 .
(7)已知酰胺键( ![]() )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 .
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中存在如下反应:A(g)+3B(g)2C(g);△H<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图: 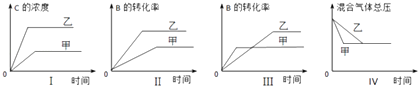
下列判断一定错误的是( )
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且乙的压强较高
C.图Ⅲ研究的是温度对反应的影响,且甲的温度较高
D.图 IV研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为 .
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 .
(3)单质B的燃烧热a kJ/mol.由B、C二种元素组成的化合物BC 14 g完全燃烧放出b kJ热量,写出单质B和单质C反应生成BC的热化学方程式: .
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2 . 在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molA2C和1mol BC、2mol A2C和2mol BC.一定条件下,充分反应后分别达到平衡(两容器温度相等).下列说法正确的是
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com