
����Ŀ��������������з�����ɫ��չ�����ÿɳ�����չ�������й�����
��1������һ����Ҫ����ԭ�ϣ��ϳɰ�ԭ����H2 �� ������Ȼ��Ϊԭ���Ƶã��йط�Ӧ�����仯��ͼ1��ʾ������CH4��g����H20��g����Ӧ�Ƶ�H2��g����CO��g�����Ȼ�ѧ����ʽΪ��
��2���������������Ź㷺��;�����ǻ�������Ⱦ���i����150��ʱ����0.4mol NO2����������Ϊ2L������ܱ������У�������Ӧ��2NO2��g��N2O4��g����
ÿ��һ��ʱ��ⶨ�����ڸ����ʵ����ʵ������������±���
ʱ��/S | 0 | 20 | 40 | 60 | 80 |
N��NO2��/mol | 0.4 | n1 | 0.26 | n3 | n4 |
N��N2O4��/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
�ٵ���Ӧ��150��ﵽƽ��ʱ���÷�Ӧƽ�ⳣ��K= �� ������ֵ��
�������ͨ��N2O4 �� ����ͬ�����´ﵽƽ��ʱ��������Ũ����Ȼ��ͬ����N2O4����ʼŨ��
ӦΪ ��
��ii����������HNO3��β���к���NO��NO2 �� ��n��NO����n��NO2��=1��1������������Һ��ȥ��������ԭ���ǣ�NO2��NO��ˮ��Ӧ���������ᣬ��������������[CO�� NH2��2]��Ӧ���ɶԻ�������
Ⱦ�����ʣ�����1mol�������ո�β�����������յ�������g��
��3��������CO2��һ�������¿ɺϳ����أ��䷴ӦΪ��2NH3��g��+CO2��g���TCO��NH2��2��s��+H2O��g��ͼ2��ʾ�ϳ����а�̼��a��CO2ת���ʦصĹ�ϵ��aΪ[n��NH3����n��CO2��]��bΪˮ̼��[n��H2O����n��CO2��]����
��bӦ��������
A.1.5��1.6 B.1��1.1 C.0.6��0.7
��aӦ������4.0�������� ��
���𰸡�
��1��CH4��g��+H2O��g���TCO��g��+3H2��g����H=+171.1KJ/mol
��2��2.8��0.10mol/L��76
��3��C��a����4.0��CO2ת����Ѹ����ߵ����ֵ����a��4.0֮������c��NH3��ת��������������
���������⣺��1���ֱ����ͼ��1��2��3��֪�Ȼ�ѧ����ʽΪ��CO��g��+1/2O2��g��=CO2��g����H=��282KJ/mol ��H2��g��+1/2O2��g��=H2O��g����H=��241.8KJ/mol ��
CH4��g��+2O2��g���TCO2��g��+2H2O��g����H=��836.3KJ/mol ��
���۩��٩��ڡ�3�ɵã�CH4��g��+H2O��g��CO��g��+3H2��g����H=+171.1KJ/mol�����Դ��ǣ�CH4��g��+H2O��g��CO��g��+3H2��g����H=+171.1KJ/mol����2����i���ٸ��ݷ���ʽ�����ʼ�ļ�������ϵ����������ʽ��֪��n1=0.3mol��n2=0.07mol��n3=0.24mol��n4=0.24mol������60minʱ��Ӧ��ƽ�⣬NO2��ƽ��Ũ��Ϊ0.12mol/L��N2O4��ƽ��Ũ��Ϊ0.04mol/L���ʷ�Ӧ��ƽ�ⳣ��K= ![]() =
= ![]() =2.8�����Դ��ǣ�2.8��
=2.8�����Դ��ǣ�2.8��
�������ͨ��N2O4 �� ����ͬ�����´ﵽƽ��ʱ��������Ũ����Ȼ��ͬ������ͨ��0.4molNO2���Чƽ�⣬���ں��º��������£����յ������ϣ�����Чƽ�⣬��Ӧ����0.2molN2O4 �� ��0.1mol/L�����Դ��ǣ�0.1mol/L��
��ii������Ŀ��Ϣ��֪��NO��NO2���������ˮ��Ӧ���������ᣬ��Ӧ����ʽΪNO+NO2+H2O=2HNO2���������������ط�Ӧ����CO2��N2 �� ��Ӧ����ʽΪCO ��NH2��2+2HNO2=CO2+2N2+3H2O��
NO+NO2 ��2HNO2 ��CO��NH2��2
��30+46��g 1mol
1mol���������չ�ҵβ���е����������NO��NO2�����Ϊ1��1��������Ϊ76g�����Դ��ǣ�76����3���ٰ�̼��a[n��NH3��/n��CO2��]��ͬʱ��ˮ̼��b[n��H2O��/n��CO2��]Ϊ0.6��0.7ʱ��������̼ת����������Դ��ǣ�A��
�ڰ�̼��a[n��NH3��/n��CO2��]����4.0ʱ�������������ʵ�����������̼��ת�������Ӳ��������������ɱ�����̼��a[n��NH3��/n��CO2��]С��4.0ʱ��������̼��ת���ʽ�С��
���Դ��ǣ���̼��a[n��NH3��/n��CO2��]����4.0ʱ�������������ʵ�����������̼��ת�������Ӳ��������������ɱ�����̼��a[n��NH3��/n��CO2��]С��4.0ʱ��������̼��ת���ʽ�С��
�����㾫�������ڱ��⿼��Ļ�ѧƽ��״̬���ʼ������ͻ�ѧƽ��ļ��㣬��Ҫ�˽⻯ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%���ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����ʵ�鷽����������________��
A���ü��ȷ���ȥ̼���ƹ����е�̼������
B������ı���ˮ��Һ�еĵ���ȡ���������þƾ�������ȡ
C��ʵ������ȡAl(OH)3����AlCl3��Һ�м���NaOH��Һ������
D����FeCl2��Һ�е���KSCN��Һ������FeCl2�Ƿ�����������
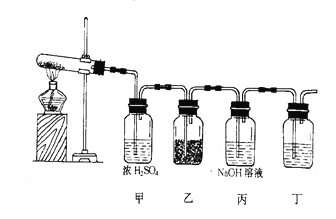
(2)ij�о���ѧϰС��Ϊ�о������Ƿ����Ư���ԣ������ͼ��ʾʵ��װ�á��Ը���ʵ��װ�ûش��������⣺

A��C��Ϊ�������ɫ������BΪ��ɫҺ�壬D��ΪNaOH��Һ��
�� �ڳ����£�KMnO4���������Ũ���ᷴӦ�����������䷴Ӧ����ʽΪ2KMnO4��16HCl(Ũ)===2KCl��2MnCl2��5Cl2����8H2O�����䷴Ӧװ��Ӧѡ�üס��ҡ����е�________��
�� B�е�Һ��Ϊ____________��������Ϊ_________________________________��
�� A��C����ɫ��������ɫ�仯�ֱ�Ϊ__________________________________��A��C��ʵ������˵�������Ƿ����Ư���ԣ�________(��ǡ���)��
�� D��NaOH��Һ��������_______________________(�����ӷ���ʽ˵��)��
�� ������������ͨ����з�̪��NaOH��Һ�У���Һ��ɫ��ȥ��С�����мס������������
�ף���������ˮ����Һ�����ԣ��к���NaOH��ʹ��Һ��Ϊ��ɫ��
�ң���������ˮ����Ư�������ʣ�ʹ��Һ��Ϊ��ɫ��
��ͬѧ����ɫ�����Һ������������NaOH��Һ����Һһֱδ����ɫ���� ________(��ס����ҡ�)�������ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.ʹ�ô����ܹ����ͻ�ѧ��Ӧ�ķ�Ӧ�ȡ�H
B.HCl��NaOH��Ӧ���к��ȡ�H=��57.3 kJ/mol����H2SO4��NH3H2O��Ӧ���к��ȡ�H=2������57.3��kJ/mol
C.��Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
D.CO��g����ȼ������283.0 kJ/mol����2CO2��g��=2CO��g��+O2��g���ġ�H=+2��283.0 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������ȷ����
A. ��Ӿ�����֤����������
B. ֱ����1��100nm֮������ӳ�Ϊ����
C. �Ƿ���ж����ЧӦ��������Һ���������Һ������
D. �������Ӻ�С����������ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǹ�ˮ����{[Cr��CH3COO��2]22H2O����Է�������Ϊ376}��һ�����ɫ���壬��������ˮ���dz��õ��������ռ���ʵ��������п�������Ȼ�����Һ����������Һ������Ϊ��Ҫԭ���Ʊ������Ǹ�ˮ�����װ����ͼ��ʾ��������2��Ԥ�ȼ���п������֪���۸����ȶ������ױ���������������п��Ӧ���Ʊ������з�������ط�Ӧ���£�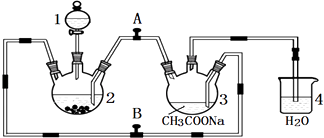
Zn��s��+2HCl��aq���TZnCl2��aq��+H2��g��
2CrCl3��aq��+Zn��s���T2CrCl2��aq��+ZnCl2��aq��
2Cr2+��aq��+4CH3COO����aq��+2H2O��l���T[Cr��CH3COO��2]22H2O��s��
��ش��������⣺
��1������1�������� ��
��2��������2�м���������Ȼ�����Һ��˳���������ѡ�����A��B��C����Ŀ���� �� A����������Ȼ�����Һͬʱ����
B���ȼ����Ȼ�����Һһ��ʱ����ټ�����
C���ȼ�����һ��ʱ����ټ����Ȼ�����Һ
��3��Ϊʹ���ɵ�CrCl2��Һ��CH3COONa��Һ˳����ϣ�Ӧ�رշ������A����B������ͬ�������� ��
��4����ʵ����п��Ҫ��������ԭ������ò�����H2��CrCl2��Һѹ��װ��3��CH3COONa��Һ��Ӧ�⣬��һ�������� ��
��5����֪������Ӧ��������ʵ��ʱȡ�õ�CrCl3��Һ�к�����9.51g��ȡ�õĴ�������ҺΪ1.5L0.1mol/L��ʵ���ø��﴿����[Cr��CH3COO��2]22H2O 9.48g�����ʵ�����ò�Ʒ�IJ���Ϊ���������ܽ�Ĵ����Ǹ�ˮ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NO2��N2O4�����ת����2NO2��g��N2O4��g����H��0���ں��������½�һ����NO2��N2O4�Ļ������ͨ��һ�ݻ�Ϊ2L���ܱ������У���Ӧ��Ũ����ʱ��仯��ϵ��ͼ������˵������ȷ���ǣ� �� 
A.ͼ�е��������ߣ�X��ʾNO2Ũ����ʱ��ı仯����
B.ǰ10 min����v��N2O4��=0.02 mol/��Lmin��
C.25 minʱ��NO2ת��ΪN2O4�ķ�Ӧ����������ԭ ���ǽ��ܱ������������СΪ1L
D.���¶��·�Ӧ��ƽ�ⳣ�� K=1.11 L/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Σ�ջ�ѧƷ�����װ�ϳ�ӡ�о�ʾ�Ա�־�����л�ѧҩƷ�����뾯ʾ�Ա�־���ƶ�Ӧ����ȷ����
A. �ƾ������綾ƷB. �����������ըƷ
C. ����������ȼƷD. ������������ʴƷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ȷ����(����)
A.����������Ũ���ᡢŨ�����Ӧ
B.������ͬ���������ۣ��ֱ���������ϡ���������������Һ��Ӧ������������ǰ�߶�
C.�Ͻ���۵�һ���������ĸ��ɷֵ��۵㶼��
D.��ҵ�ϳ��������ȷ�Ӧұ�����۵Ľ������緰
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ���У������Թ��ڵİ�ɫ����A��A����ɫ��ӦΪ��ɫ�������ɰ�ɫ����B���ų�����C��D����Щ����ͨ����ƿ��Ũ�����C�����գ�D������ƿ����һ����ɫ����E��Ӧ���ɰ�ɫ����B������F����ƿ�е�NaOH��Һ��������ʣ�������D��
��1��д�������ʵĻ�ѧʽ��
A______�� B_______�� C________�� D______�� E_______�� F___________��
��2��д���Թ��м���ƿ�з�Ӧ�Ļ�ѧ����ʽ��_______________��__________________��
��3�������ʵ���A��B�ֱ������������ᷴӦ������������________���һ���ࡱ����ǰ�߶ࡱ�������߶ࡱ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com