
【题目】下列叙述中,正确的是( )
A.常温下铝和浓硫酸、浓硝酸不反应
B.两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多
C.合金的熔点一般比组成它的各成分的熔点都高
D.工业上常利用铝热反应冶炼难熔的金属,如钒
科目:高中化学 来源: 题型:
【题目】下列有关糖类物质的叙述不正确的是
A.纤维素是高分子化合物
B.常温下淀粉溶液遇碘单质变蓝
C.糖类是由C、H、N三种元素组成的
D.淀粉除做食物外,主要用来生产葡萄糖和酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物的研发与绿色反展、经济可持续发展有着密切关联.
(1)氨是一种重要化工原料.合成氨原料气H2 , 可用天然气为原料制得,有关反应能量变化如图1所示.则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:
(2)氮的氧化物有着广泛用途,又是环境的污染物.(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如下表:
时间/S | 0 | 20 | 40 | 60 | 80 |
N(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
N(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①当反应在150℃达到平衡时,该反应平衡常数K= . (填数值)
②若最初通入N2O4 , 在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度
应为 .
(ii)氨氧化制HNO3的尾气中含有NO和NO2 , 且n(NO):n(NO2)=1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素[CO( NH2)2]反应生成对环境无污
染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)图2表示合成塔中氨碳比a与CO2转化率ω的关系.a为[n(NH3):n(CO2)],b为水碳比[n(H2O):n(CO2)].则:
①b应控制在;
A.1.5~1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将浓度为0.1 mol?L﹣1HF溶液加水不断稀释过程中,c(H+)和c(OH﹣)都会减小
B.25℃时,等体积、等pH的HCl、H2SO4、CH3COOH溶液分别与足量锌粉反应,H2SO4溶液产生的H2量最多
C.Na2CO3溶液存在水解平衡:CO ![]() +H2O?HCO
+H2O?HCO ![]() +OH﹣ , 加入NaOH固体会使平衡逆向移动,溶液pH减小
+OH﹣ , 加入NaOH固体会使平衡逆向移动,溶液pH减小
D.25℃时,pH均为8的CH3COONa和NaOH溶液中,由水电解产生的c(OH﹣)之比为100:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中存在如下反应:A(g)+3B(g)2C(g);△H<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图: 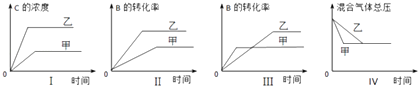
下列判断一定错误的是( )
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且乙的压强较高
C.图Ⅲ研究的是温度对反应的影响,且甲的温度较高
D.图 IV研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。

(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_____。
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。

(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2+H2O |
②SO2+CaO=CaSO3 | ||
③_______ | ||
S元素价态 | S为+4价 | ①_______ |
②SO2 +2H2S=3S+2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如下图所示:
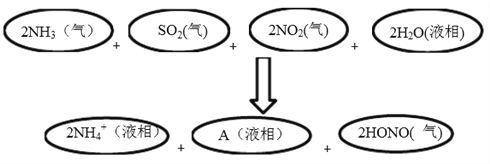
请判断A的化学式并说明判断理由:______________________。
(5)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
离子 | Na+ | SO42 | NO3 | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.0×104 | 3.4×103 |
①SO2和NaClO2溶液反应的离子方程式是_________________。
②表中y =______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 6.02×1023个分子的体积约是22.4 L
B. 0.5 mol H2的体积为11.2 L
C. 1 mol气体的体积为22.4 L,则一定是在标准状况下
D. 标准状况下,体积相同的气体所含的分子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取Xg镁和铝的混合物,向其中加入适量的稀盐酸,恰好完全反应生成标准状况下的气体BL向反应后的溶液中加入VmLCmol/L氢氧化钠溶液,使金属离子刚好沉淀完全,得到的沉淀质量为Yg.再将得到的沉淀灼烧至质量不再改变为止,得到固体Pg.则下列关系不正确的是( )
A.![]() X<P<
X<P< ![]() X
X
B.P=X+ ![]()
C.Y=X+V?C
D.C= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题:
(1)高温下发生的反应②中,若F为常见的金属单质,H是非金属单质,用化学方程式表示G的一个重要用途: .
(2)若F为淡黄色粉末,①写出反应②的化学方程式并用双线桥标出电子转移的方向和数目 .
②F的电子式 .
(3)若A是一种强酸,B是一含有两种金属元素的盐,且其水溶液显碱性,写出①反应的离子方程式 .
(4)若A、F、H是短周期且相邻的两个族的元素单质,且反应均在溶液中进行,请写出:①的离子方程式;
②的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com