
ΓΨΧβΡΩΓΩ÷–ΙζΩΤ―ß‘ΚΙΌΖΫΈΔ–≈”Ύ2017Ρξ3‘¬ΖΔ±μΓΕΜ“ω≤Ή®ΧβΓΖΘ§Χα≥ωΜ“ω≤÷–œΗΩ≈ΝΘΈοΒΡ≥…“ρΘ§≤ΩΖ÷Ζ÷Έω»γœ¬ΆΦΥυ ΨΓΘ

Θ®1Θ©ΗυΨί…œΆΦ–≈œΔΩ…“‘Ω¥≥ωΘ§œ¬Ν–ΡΡ÷÷ΤχΧεΈέ»ΨΈο≤Μ «”…ΜζΕ·≥Β–– Μ‘λ≥…ΒΡ_____ΓΘ
aΘ°SO2 bΘ°NOx cΘ°VOCs dΘ° NH3
Θ®2Θ©ΜζΕ·≥Β¥σΝΩ–– Μ «Έέ»Ψ‘¥÷°“ΜΓΘΤϊ≥ΒΖΔΕ·ΜζΖœΤχœΓ»ΦΩΊ÷ΤœΒΆ≥÷ς“ΣΙΛΉς‘≠άμ»γΆΦΥυ ΨΘΜ–¥≥ωœΓ»ΦΙΐ≥Χ÷–NOΖΔ…ζΒΡ÷ς“ΣΖ¥”ΠΒΡΖΫ≥Χ Ϋ_______ΓΘ

Θ®3Θ©SO2 «ΤχΧεΈέ»ΨΈοΒΡ÷ς“Σ≥…Ζ÷÷°“ΜΓΘΉςΈΣ“Μ÷÷Μ·―ß–‘÷ ΜνΤΟΒΡΈο÷ Θ§ΥϋΡήΖΔ…ζΕύ÷÷Ζ¥”ΠΘ§«κΑ¥’’œ¬±μΧα ΨΘ§¥”≤ΜΆ§Ϋ«Ε» αάμSO2≤ΜΆ§άύΒΡΜ·―ß–‘÷ Θ§ΫΪΜ·―ßΖΫ≥Χ ΫΧν‘Ύœ¬±μ÷–ΓΘ
SO2–‘÷ αάμ | Μ·―ßΖΫ≥Χ Ϋ | |
Έο÷ άύ±π | Υα–‘―θΜ·Έο | ΔΌSO2+H2O |
ΔΎSO2+CaO=CaSO3 | ||
Δέ_______ | ||
S‘ΣΥΊΦέΧ§ | SΈΣ+4Φέ | ΔΌ_______ |
ΔΎSO2 +2H2S=3S+2H2O | ||
Θ®4Θ©ΩΤ―ßΦ“Ψ≠Ιΐ―–ΨΩΖΔœ÷÷–Ιζω≤≥ ÷––‘Θ§Τδ÷ς“Σ‘≠“ρ»γœ¬ΆΦΥυ ΨΘΚ
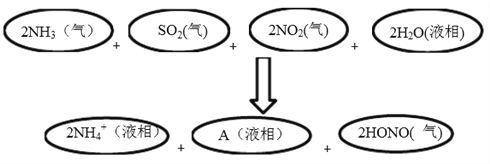
«κ≈–ΕœAΒΡΜ·―ß Ϋ≤ΔΥΒΟς≈–Εœάμ”…ΘΚ______________________ΓΘ
Θ®5Θ©ΟΚ»Φ…’≈≈Ζ≈ΒΡ―ΧΤχΚ§”–SO2ΚΆNOxΘ§≤…”ΟNaClO2»ή“ΚΉςΈΣΈϋ ’ΦΝΩ…Ά§ ±Ε‘―ΧΤχΫχ––Ά―ΝρΓΔΆ―œθΓΘΫΪΚ§”–SO2ΚΆNOxΒΡ―ΧΤχΆ®»κ Δ”–NaClO2»ή“ΚΒΡΖ¥”ΠΤς÷–Θ§Ζ¥”Π“ΜΕΈ ±ΦδΚσΘ§≤βΒΟ»ή“Κ÷–άκΉ”≈®Ε»ΒΡ”–ΙΊ ΐΨί»γœ¬Θ®ΤδΥϊάκΉ”Κω¬‘≤ΜΦΤΘ©ΘΚ
άκΉ” | Na+ | SO42 | NO3 | H+ | Cl |
≈®Ε»/Θ®molΓΛL1Θ© | 5.5ΓΝ103 | 8.5ΓΝ104 | y | 2.0ΓΝ104 | 3.4ΓΝ103 |
ΔΌSO2ΚΆNaClO2»ή“ΚΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «_________________ΓΘ
ΔΎ±μ÷–y ΘΫ______ΓΘ
ΓΨ¥πΑΗΓΩ a 2NO+O2=2NO2 SO2+2NaOH=Na2SO3+H2O 2SO2+O2![]() 2SO3 SO42-Θ§“ρΈΣΖ¥”Π÷°«ΑSΈΣ+4ΦέΘ§NΈΣ+4ΦέΘ§Ζ¥”Π÷°ΚσHONO÷–N‘ΣΥΊΒΡΦέΧ§ΈΣ+3ΦέΘ§ΒΣ‘ΣΥΊΜ·ΚœΦέΫΒΒΆΘ§±Ί”–‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘ§ΉέΚœΆΤΕœΘ§”Π «S‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘΚ¥”+4…ΐΗΏΒΫ+6ΦέΘ§‘Ύ“Κœύ”Π“‘SO42-–Έ Ϋ¥φ‘ΎΓΘ 2SO2+ClO2-+2H2O=2SO42-+Cl- +4H+ 6ΓΝ104
2SO3 SO42-Θ§“ρΈΣΖ¥”Π÷°«ΑSΈΣ+4ΦέΘ§NΈΣ+4ΦέΘ§Ζ¥”Π÷°ΚσHONO÷–N‘ΣΥΊΒΡΦέΧ§ΈΣ+3ΦέΘ§ΒΣ‘ΣΥΊΜ·ΚœΦέΫΒΒΆΘ§±Ί”–‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘ§ΉέΚœΆΤΕœΘ§”Π «S‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘΚ¥”+4…ΐΗΏΒΫ+6ΦέΘ§‘Ύ“Κœύ”Π“‘SO42-–Έ Ϋ¥φ‘ΎΓΘ 2SO2+ClO2-+2H2O=2SO42-+Cl- +4H+ 6ΓΝ104
ΓΨΫβΈωΓΩΘ®1Θ©ΗυΨί…œΆΦ–≈œΔΩ…“‘Ω¥≥ωΜζΕ·≥Β–– Μ‘λ≥…ΒΡΈέ»Ψ”–NOxΓΔVOCsΓΔNH3Θ§SO2≤Μ «”…ΜζΕ·≥Β–– Μ‘λ≥…ΒΡΘ§¥πΑΗ―ΓaΘΜΘ®2Θ©œΓ»ΦΙΐ≥Χ÷–NO±Μ―θΤχ―θΜ·…ζ≥…NO2Θ§ΖΔ…ζΒΡ÷ς“ΣΖ¥”ΠΒΡΖΫ≥Χ ΫΈΣ2NO+O2=2NO2ΓΘΘ®3Θ©SO2ΉςΈΣΥα–‘―θΜ·ΈοΘ§Ρή”κΦνΖ¥”Π…ζ≥…―ΈΚΆΥ°ΘΚSO2+2NaOHΘΫNa2SO3+H2OΘΜ+4ΦέΒΡSΦ»Ω…“‘ΒΟΒΫΒγΉ”ΖΔ…ζΜΙ‘≠Ζ¥”ΠΘ§“≤Ω…“‘ ß»ΞΒγΉ”Θ§ΖΔ…ζ―θΜ·Ζ¥”ΠΘΚ2SO2+O2![]() 2SO3ΘΜΘ®4Θ©“ρΈΣΖ¥”Π÷°«ΑSΈΣ+4ΦέΘ§NΈΣ+4ΦέΘ§Ζ¥”Π÷°ΚσHONO÷–N‘ΣΥΊΒΡΦέΧ§ΈΣ+3ΦέΘ§ΒΣ‘ΣΥΊΜ·ΚœΦέΫΒΒΆΘ§±Ί”–‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘ§ΉέΚœΆΤΕœΘ§”Π «S‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘΚ¥”+4…ΐΗΏΒΫ+6ΦέΘ§‘Ύ“Κœύ”Π“‘SO42-–Έ Ϋ¥φ‘ΎΘ§Φ¥ΕœAΒΡΜ·―ß ΫΈΣSO42-ΓΘΘ®5Θ©ΔΌSO2ΚΆNaClO2»ή“ΚΖΔ…ζ―θΜ·ΜΙ‘≠Ζ¥”Π…ζ≥…ΝρΥαΗυΓΔ¬»άκΉ”Θ§ΗυΨίΒγΉ”ΒΟ ß ΊΚψΓΔΒγΚ… ΊΚψ“‘ΦΑ‘≠Ή” ΊΚψΩ…÷ΣΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «2SO2+ClO2-+2H2O=2SO42-+Cl- +4H+ΓΘΔΎ”…”Ύ»ή“Κœ‘Βγ÷––‘Θ§‘ρ±μ÷–yΘΫ5.5ΓΝ103+2.0ΓΝ104®D3.4ΓΝ103®D2ΓΝ8.5ΓΝ104ΘΫ6ΓΝ104ΓΘ
2SO3ΘΜΘ®4Θ©“ρΈΣΖ¥”Π÷°«ΑSΈΣ+4ΦέΘ§NΈΣ+4ΦέΘ§Ζ¥”Π÷°ΚσHONO÷–N‘ΣΥΊΒΡΦέΧ§ΈΣ+3ΦέΘ§ΒΣ‘ΣΥΊΜ·ΚœΦέΫΒΒΆΘ§±Ί”–‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘ§ΉέΚœΆΤΕœΘ§”Π «S‘ΣΥΊΜ·ΚœΦέ…ΐΗΏΘΚ¥”+4…ΐΗΏΒΫ+6ΦέΘ§‘Ύ“Κœύ”Π“‘SO42-–Έ Ϋ¥φ‘ΎΘ§Φ¥ΕœAΒΡΜ·―ß ΫΈΣSO42-ΓΘΘ®5Θ©ΔΌSO2ΚΆNaClO2»ή“ΚΖΔ…ζ―θΜ·ΜΙ‘≠Ζ¥”Π…ζ≥…ΝρΥαΗυΓΔ¬»άκΉ”Θ§ΗυΨίΒγΉ”ΒΟ ß ΊΚψΓΔΒγΚ… ΊΚψ“‘ΦΑ‘≠Ή” ΊΚψΩ…÷ΣΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «2SO2+ClO2-+2H2O=2SO42-+Cl- +4H+ΓΘΔΎ”…”Ύ»ή“Κœ‘Βγ÷––‘Θ§‘ρ±μ÷–yΘΫ5.5ΓΝ103+2.0ΓΝ104®D3.4ΓΝ103®D2ΓΝ8.5ΓΝ104ΘΫ6ΓΝ104ΓΘ


 ΫΧ”ΐ άΦ“Ή¥‘ΣΨμœΒΝ–¥πΑΗ
ΫΧ”ΐ άΦ“Ή¥‘ΣΨμœΒΝ–¥πΑΗ ΜΤΗ‘ΩΈΧΟΉς“Β±ΨœΒΝ–¥πΑΗ
ΜΤΗ‘ΩΈΧΟΉς“Β±ΨœΒΝ–¥πΑΗ ΒΞ‘ΣΦ”ΤΎΡ©Η¥œΑœ»Ζφ¥σΩΦΨμœΒΝ–¥πΑΗ
ΒΞ‘ΣΦ”ΤΎΡ©Η¥œΑœ»Ζφ¥σΩΦΨμœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜ·―ß”κ…ζ≤ζΓΔ…ζΜνΟή«–œύΙΊΓΘœ¬Ν–”–ΙΊΈο÷ ”ΟΆΨΒΡ–π ω≤Μ’ΐ»ΖΒΡ «Θ®Θ©
A.ΟςΖ·Ω…”ΟΉςΨΜΥ°ΦΝB.NH4HCO3Ω…”ΟΉςΒΣΖ
C.FeCl3»ή“ΚΩ…”Ο”ΎΗ· ¥”ΓΥΔΒγ¬ΖΑεD.NaOHΩ…”Ο”Ύ÷ΈΝΤΈΗΥαΙΐΕύΒΡΦ≤≤Γ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣNO2ΚΆN2O4Ω…“‘œύΜΞΉΣΜ·ΘΚ2NO2Θ®gΘ©N2O4Θ®gΘ©ΓςHΘΦ0Θ°‘ΎΚψΈ¬ΧθΦΰœ¬ΫΪ“ΜΕ®ΝΩNO2ΚΆN2O4ΒΡΜλΚœΤχΧεΆ®»κ“Μ»ίΜΐΈΣ2LΒΡΟή±’»ίΤς÷–Θ§Ζ¥”ΠΈο≈®Ε»Υφ ±Φδ±δΜ·ΙΊœΒ»γΆΦΘ°œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ© 
A.ΆΦ÷–ΒΡΝΫΧθ«ζœΏΘ§X±μ ΨNO2≈®Ε»Υφ ±ΦδΒΡ±δΜ·«ζœΏ
B.«Α10 minΡΎ”ΟvΘ®N2O4Θ©=0.02 mol/Θ®LminΘ©
C.25 min ±Θ§NO2ΉΣ±δΈΣN2O4ΒΡΖ¥”ΠΥΌ¬ ‘ω¥σΘ§Τδ‘≠ “ρ «ΫΪΟή±’»ίΤςΒΡΧεΜΐΥθ–ΓΈΣ1L
D.ΗΟΈ¬Ε»œ¬Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐ K=1.11 L/mol
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ”ΟΆ≠–ΩΚœΫπ÷Τ≥…ΒΡΦΌΫπ‘Σ±ΠΤέΤ≠»ΥΒΡ ¬Φΰ¬≈”–ΖΔ…ζΓΘœ¬Ν–≤Μ“Ή«χ±πΤδ’φΈ±ΒΡΖΫΖ® «(ΓΓΓΓ)
A.≤βΕ®ΟήΕ»
B.Ζ≈»κœθΥα÷–
C.Ζ≈»κ―ΈΥα÷–
D.Ιέ≤λΆβΙέ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν––π ω÷–Θ§’ΐ»ΖΒΡ «(ΓΓΓΓ)
A.≥ΘΈ¬œ¬¬ΝΚΆ≈®ΝρΥαΓΔ≈®œθΥα≤ΜΖ¥”Π
B.ΝΫΖίœύΆ§÷ ΝΩΒΡ¬ΝΖέΘ§Ζ÷±π”κΉψΝΩΒΡœΓΝρΥαΚΆ«β―θΜ·ΡΤ»ή“ΚΖ¥”ΠΘ§≤ζ…ζΒΡ«βΤχ«Α’ΏΕύ
C.ΚœΫπΒΡ»έΒψ“ΜΑψ±»Ήι≥…ΥϋΒΡΗς≥…Ζ÷ΒΡ»έΒψΕΦΗΏ
D.ΙΛ“Β…œ≥Θάϊ”Ο¬Ν»»Ζ¥”Π“±ΝΕΡ―»έΒΡΫπ τΘ§»γΖΑ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Έ¬Ε»œ¬Θ§ΫΪ3molAΚΆ3molB≥δ»κΧεΜΐΈΣ 1LΒΡΟή±’»ίΤς÷–Θ§ΖΔ…ζ»γœ¬Ζ¥”ΠΘΚaAΘ®gΘ©+2BΘ®gΘ©3CΘ®gΘ©+DΘ®gΘ©Θ°Ζ¥”Π¥οΒΫΤΫΚβΚσΘ§CΒΡ≈®Ε»ΈΣ 3mol/LΘ°―ΙΥθ»ίΤςΧεΜΐΘ§ Ι»ίΤςΒΡΧεΜΐΦθ–Γ“ΜΑκΘ§Ϋ®ΝΔ–¬ΒΡΤΫΚβ ±Θ§BΒΡ≈®Ε»ΈΣ2mol/LΘ°‘ρΖΫ≥Χ Ϋ÷–aΒΡ ΐ÷ΒΈΣΘ® Θ©
A.1
B.2
C.3
D.4
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»ΐ≤ίΥαΚœΧζΥαΦΊΨßΧεK3[FeΘ®C2O4Θ©3]3H2OΩ…”Ο”Ύ…ψ”ΑΚΆάΕ…Ϊ”ΓΥΔΘ°Ρ≥–ΓΉιΫΪΈόΥ°»ΐ≤ίΥαΚœΧζΥαΦΊ‘Ύ“ΜΕ®ΧθΦΰœ¬Φ”»»Ζ÷ΫβΘ§Ε‘ΥυΒΟΤχΧε≤ζΈοΚΆΙΧΧε≤ζΈοΫχ–– Β―ιΚΆΧΫΨΩΘ°ΗΟ–ΓΉιΆ§―ß≤ι‘ΡΉ Νœ÷ΣΘ§ΙΧΧε≤ζΈο÷–Χζ‘ΣΥΊ≤ΜΩ…Ρή“‘»ΐΦέ–Έ Ϋ¥φ‘ΎΘ§Εχ―Έ÷Μ”–K2CO3 Θ§ ≤ζ…ζΒΡΤχΧε÷–Κ§”–COΓΔCO2 Θ° «κάϊ”Ο Β―ι “≥Θ”Ο“«ΤςΓΔ”ΟΤΖΚΆ“‘œ¬œό―Γ ‘ΦΝΆξ≥…―ι÷ΛΚΆΧΫΨΩΙΐ≥ΧΘ°
œό―Γ ‘ΦΝΘΚΔΌ’τΝσΥ° ΔΎ3%H2O2»ή“Κ Δέ―θΜ·Ά≠ Δή1.0 molL©¹1―ΈΥαΔί≈®ΝρΥαΔό1.0 molL©¹1NaOH»ή“Κ ΔΏ≥Έ«ε ·Μ“Υ° Δύ0.5 molL©¹1 CuSO4»ή“Κ Δα2%KSCN»ή“Κ Δβ±ΫΖ”»ή“Κ
Θ®1Θ©»τ”Ο“ΜΧΉΝ§–χ Β―ιΉΑ÷ΟΦλ―ιΤχΧε≤ζΈο÷–COΒΡ¥φ‘ΎΘ§≤Δ―ι÷ΛΦλ―ιΙΐ≥Χ÷–”–CO2…ζ≥…Θ§”Π―Γ”ΟΒΡ ‘ΦΝΈΣΘ®Α¥œ»ΚσΥ≥–ρΑ―Υυ―Γ ‘ΦΝΒΡ±ξΚ≈Χν»κΩ’ΗώΡΎΘ©
Θ®2Θ©Χα≥ωΚœάμΦΌ…ηΦΌ…η1ΘΚ÷Μ”–FeΘΜ ΦΌ…η2ΘΚ÷Μ”–FeOΘΜ ΦΌ…η3ΘΚ Θ°
Θ®3Θ©…ηΦΤ Β―ιΖΫΑΗ≤Δ Β―ι―ι÷Λ≤Ϋ÷η1ΘΚ»Γ ΝΩΙΧΧε≤ζΈο”Ύ ‘Ιή÷–Θ§Φ”»κΉψΝΩ’τΝσΥ°»ήΫβΘ§Ιΐ¬ΥΖ÷άκ≥ω≤Μ»ήΙΧΧεΘ°
≤Ϋ÷η2ΘΚ»Γ…ΌΝΩ…œ ω≤Μ»ήΙΧΧεΖ≈»κ ‘Ιή÷–Θ§Φ”»κΉψΝΩ»ή“ΚΘ§≥δΖ÷’ώΒ¥Θ°»τΙΧΧεΈόΟςœ‘±δΜ·Θ§‘ρΦΌ…η≥…ΝΔΘΜ»τ”–ΑΒΚλ…ΪΙΧΧε…ζ≥…Θ§‘ρΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ Θ°
≤Ϋ÷η3ΘΚ»Γ≤Ϋ÷η2ΥυΒΟΑΒΚλ…ΪΙΧΧε”Ύ ‘Ιή÷–Θ§ΒΈΦ”ΙΐΝΩ Θ§ ’ώΒ¥ΚσΨ≤÷ΟΘ°»τ»ή“ΚΜυ±ΨΈό…ΪΘ§‘ρΦΌ…η≥…ΝΔΘΜ»τ»ή“Κ≥ Θ§ ‘ρΦΌ…η3≥…ΝΔΘ°
Θ®4Θ©Έ ΧβΧ÷¬έ»τΙΧΧε≤ζΈο÷–FeOΚ§ΝΩΫœ…ΌΘ§”Ο≤Ϋ÷η3ΖΫΖ®Ρ―“‘»ΖΕ®Θ°«κΡψ…ηΦΤ Β―ιΖΫΑΗ÷ΛΟςΦΌ…η3≥…ΝΔΘ®–¥≥ω Β―ιΒΡ≤ΌΉς≤Ϋ÷ηΓΔœ÷œσ”κΫα¬έΘ©ΘΚ Θ°
Θ®5Θ©ΆΊ’Ι”κ―”…λ”–Ή ΝœΫι…ήΓΑ‘ΎΚ§Fe2+ΒΡ»ή“Κ÷–Θ§œ»ΒΈΦ”…ΌΝΩ–¬÷Τ±ΞΚΆ¬»Υ°Θ§»ΜΚσΒΈΦ”KSCN»ή“ΚΘ§»ή“Κ≥ Κλ…ΪΘΜ»τ‘ΌΒΈΦ”ΙΐΝΩ¬»Υ°Θ§»¥ΖΔœ÷Κλ…ΪΆ »ΞΓ±Θ°ΦΌ…η»ή“Κ÷–ΒΡ+3ΦέΧζΜΙΡή±Μ¬»Υ°―θΜ·ΈΣΗϋΗΏΦέΒΡQUOTEΘ§ ‘–¥≥ωΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ Θ°
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΗςΉιΈο÷ Ζ÷άύ’ΐ»ΖΒΡ «( )
Υα | Φν | ―Έ | ―θΜ·Έο | |
A | ΝρΥα | ¥ΩΦν | ·Ηύ | ΧζΚλ |
B | «βΝρΥα | …’Φν | ¥ΩΦν | …ζ ·Μ“ |
C | ΧΦΥα | λ ·Ηύ | –ΓΥ’¥ρ | Εΰ―θΜ·Νρ |
D | Εΰ―θΜ·ΧΦ | ΩΝ–‘ΦΊ | ≥―Έ | ·Μ“ · |
A. AB. BC. CD. D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ“ΜΕ®Έ¬Ε»œ¬Θ§ΫΪ0.2molΒΡΒβΜ·«β≥δ»κ1LΒΡΟή±’»ίΤς÷–Θ§≥δΖ÷Ζ¥”ΠΘ§¥οΒΫΤΫΚβΚσΘ§≤βΒΟcΘ®H2Θ©=0.08mol/LΘ°
Θ®1Θ©«σΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΘ°
Θ®2Θ©‘Ύ…œ ωΈ¬Ε»œ¬Θ§ΗΟ»ίΤς÷–»τ≥δ»κΒβΜ·«β0.4molΘ§«σ¥οΒΫΤΫΚβ ±ΒβΜ·«βΒΡΉΣΜ·¬ ΚΆ«βΤχΒΡΈο÷ ΒΡΝΩ≈®Ε»Θ°
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com