
【题目】化学与生产、生活密切相关。下列有关物质用途的叙述不正确的是()
A.明矾可用作净水剂B.NH4HCO3可用作氮肥
C.FeCl3溶液可用于腐蚀印刷电路板D.NaOH可用于治疗胃酸过多的疾病
科目:高中化学 来源: 题型:
【题目】立方烷( ![]() )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: 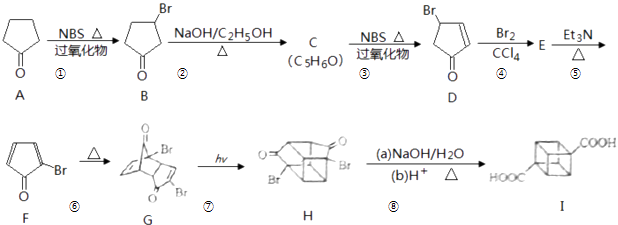
回答下列问题:
(1)C的结构简式为 , E的结构简式为 .
(2)③的反应类型为 , ⑤的反应类型为 .
(3)化合物A可由环戊烷经三步反应合成:![]()
反应I的试剂与条件为,反应2的化学方程式为 , 反应3可用的试剂为 .
(4)在I的合成路线中,互为同分异构体的化合物是 . (填化合物代号)
(5)I与碱石灰共热可化为立方烷.立方烷的核磁共振氢谱中有个峰.
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮(如图1)是一种重要的化工原料,实验室常用下列原理和装置制备(部分夹持仪器未画出)(如图2):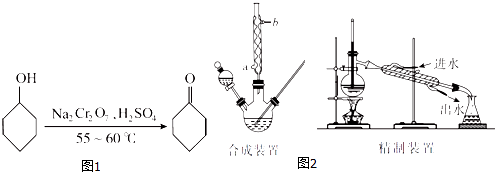
环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
物质 | 相对分子质量 | 沸点(℃) | 密度(gcm﹣3 , 20℃) | 溶解性 |
环己醇 | 100 | 161.1(97.8) | 0.9624 | 能溶于水 |
环己酮 | 98 | 155.6(95) | 0.9478 | 微溶于水 |
水 | 18 | 100.0 | 0.9982 |
(1)已知合成环己酮的反应是放热反应,反应剧烈将导致体系温度迅速上升,副反应增多.实验时,先在合成装置中加入5.2 mL(5 g)环己醇和几粒沸石,再加入酸性Na2Cr2O7溶液.酸性Na2Cr2O7溶液的加料方式为(填代号).
A.一次性加入
B.缓慢加入
C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35 mL,则应选取(填“100 mL”或“250mL”)的三颈瓶.
(3)反应完成后,加入适量水,蒸馏,收集95~100℃的馏分(设为A),其主要成分是的混合物.
(4)合成装置中冷凝管的作用是 , 冷凝水从冷凝管的(填“a”或“b”)口进入.
(5)在馏分A中加入氯化钠固体至饱和,振荡、静置、分液,得有机层(设为B).加入氯化钠固体的作用是 .
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分.过滤,将滤液置于精制装置中蒸馏,收集(填代号)的馏分,得到纯净的环己酮.
A.100.0~102.0℃
B.154.0~156.0℃
C.160.0~162.0℃
(7)精制装置中的错误是 . (任写一点)
(8)若最终得到环己酮的质量为3.43 g,则环己酮的产率是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):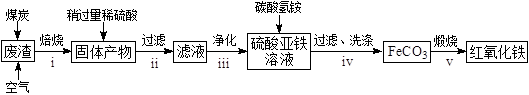
回答下列问题:
①在步骤i中产生的有毒气体可能有。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×1032 , 此时理论上将Al3+沉淀完全,则溶液的pH为。
③步骤iv中,生成FeCO3的离子方程式是。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
复分解反应ii的离子方程式是。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN , 方案如下:![]()
若试纸变蓝则证明食品中含有CN , 请解释检测时试纸中FeSO4的作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类物质的叙述不正确的是
A.纤维素是高分子化合物
B.常温下淀粉溶液遇碘单质变蓝
C.糖类是由C、H、N三种元素组成的
D.淀粉除做食物外,主要用来生产葡萄糖和酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( ) 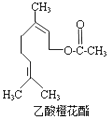
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
A.①②③
B.①②⑤
C.②④⑥
D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g)+3B(g)xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(Lmin),D的平衡浓度为0.3mol/L,又知v(B):v(C)=3:2,则下列说法中正确的是( )
A.x:y=3:1
B.v(A):v(C)=2:1
C.A的平衡浓度为0.4mol/L
D.A与B的平衡浓度之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。

(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_____。
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。

(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2+H2O |
②SO2+CaO=CaSO3 | ||
③_______ | ||
S元素价态 | S为+4价 | ①_______ |
②SO2 +2H2S=3S+2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如下图所示:
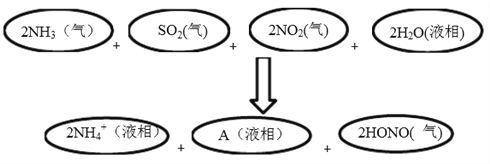
请判断A的化学式并说明判断理由:______________________。
(5)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
离子 | Na+ | SO42 | NO3 | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.0×104 | 3.4×103 |
①SO2和NaClO2溶液反应的离子方程式是_________________。
②表中y =______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com