
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):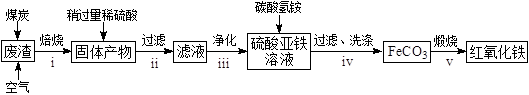
回答下列问题:
①在步骤i中产生的有毒气体可能有。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×1032 , 此时理论上将Al3+沉淀完全,则溶液的pH为。
③步骤iv中,生成FeCO3的离子方程式是。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
复分解反应ii的离子方程式是。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN , 方案如下:![]()
若试纸变蓝则证明食品中含有CN , 请解释检测时试纸中FeSO4的作用。
【答案】
(1)c
(2)CO 和 SO2;5;Fe2++2HCO3?==FeCO3↓+CO2↑+H2O
(3)Fe(OH)3;Fe3++3H2O ![]() Fe(OH)3+3H+ , 加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成 Fe(OH)3沉淀。
Fe(OH)3+3H+ , 加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成 Fe(OH)3沉淀。
(4)3[Fe(CN)6]4?+ 4Fe3+== Fe4[Fe(CN)6]3↓;②碱性条件下,Fe2+与CN?结合生成[Fe(CN)6]4?;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4?与 Fe3+反应生成普鲁士蓝使试纸显蓝色
【解析】解:(1)天然磁石成分为磁铁矿,主要成分是Fe3O4 , c正确。(2)①煤炭在空气中燃烧生成CO 和 SO2等有毒气体。②理论上当c(Al3+)≤1.0×10-5mol·L-1时认为Al3+已沉淀完全,以c(Al3+)=1.0×10-5mol·L-1代入Ksp[Al(OH)3]= c(Al3+)×c3(OH-)=1.0×1032
, 可求得c(OH-)=1.0×109 mol·L-1 , 则此时溶液的pH=5。③步骤iⅤ中,根据流程图可知,反应物为HCO3-和Fe2+ , 生成物为FeCO3 , 根据原子守恒判断,应有H+生成,但H+可以与HCO3-继续反应生成CO2和H2O,,所以整个过程离子方程式为: Fe2++2HCO3==FeCO3↓+CO2↑+H2O。(3)Cu2+和Fe3+均能水解而使溶液显酸性,但Fe3+的水解程度比Cu2+的大,Fe3+的水解反应为Fe3++3H2O ![]() Fe(OH)3+3H+ , 加入CuO能与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀。(4)①直接从合成方法图示可看出,[Fe(CN)6]4与Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,离子方程式为: 3[Fe(CN)6]4+ 4Fe3+== Fe4[Fe(CN)6]3↓。②碱性条件下,HCN转化为CN-。FeSO4中的Fe2+
Fe(OH)3+3H+ , 加入CuO能与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀。(4)①直接从合成方法图示可看出,[Fe(CN)6]4与Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,离子方程式为: 3[Fe(CN)6]4+ 4Fe3+== Fe4[Fe(CN)6]3↓。②碱性条件下,HCN转化为CN-。FeSO4中的Fe2+
与CN-结合生成[Fe(CN)6]4、Fe2+被空气中的氧气氧化生成Fe3+;[Fe(CN)6]4与Fe3+反应生成普鲁士蓝使试纸显蓝色,从而达到检测食品中CN-的目的。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氧化还原反应的本质是化合价发生了变化 B. 化合价升高的物质被氧化
C. 得到电子的物质被氧化 D. 氧化还原反应中,先有氧化后有还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照一定标准,根据物质与水反应的不同情况,对下列物质进行分类,如图所示,请填空:
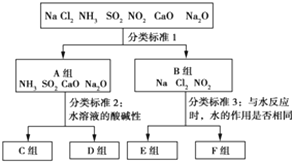
(1)上图中分类标准1(分成A、B组的依据)为_________________________________。
(2)工业上常用D组中________________(填化学式),来消除C组中物质对大气的污染,该反应的化学方程式为_____________________________________________。
(3)实验室由Al3+制备Al(OH)3时,应选择D组中________(填化学式)的水溶液,离子方程式为__________________________。
(4)F组中有两种物质,在工业上均有重要的用途,请各写出一个化学方程式表示其用途: ________________________________;________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的一些问题常涉及到化学知识,下列叙述不正确的是()。
A.糯米中的淀粉一经发生水解反应,就酿造成酒
B.福尔马林是一种良好的杀菌剂,但不可用来消毒饮用水
C.棉花和人造丝的主要成分都是纤维素
D.室内装饰材料中缓慢释放出的甲醛、甲苯等有机物会污染空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示: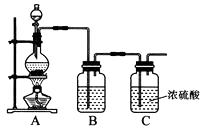
①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为。
②实验室制Cl2时,装置B中盛放的试剂为 , 其作用是。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。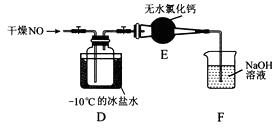
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为。
②装置D中的现象为。
③装置E中无水氯化钙的作用为。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是。
(3)NO可用间接电化学法除去,其原理如下图所示:
①阴极的电极反应式为。
②吸收塔内发生反应的离子方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算浓度时假定溶液体积没有变化):
①向其中一份固体中加入100mL 2.0mol/L的NaOH溶液,加热使其充分反应后过滤,测得滤液的c(OH-)=1mol/L;
②向另一份固体中加入140mL 4.0 mol/L的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=1mol/L。
(1)写出该铝热反应的化学方程式:_______________________________
写出实验①发生的离子方程式:_________________________________。
(2)这包铝热剂中铝粉的质量为___________________________。
(3)这包铝热剂中氧化铁粉末的质量为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列有关物质用途的叙述不正确的是()
A.明矾可用作净水剂B.NH4HCO3可用作氮肥
C.FeCl3溶液可用于腐蚀印刷电路板D.NaOH可用于治疗胃酸过多的疾病
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥蒸发,一定要用到玻璃棒的是( )
A. ①②⑥B. ②③⑥C. ③④⑥D. ④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com