
【题目】下列说法正确的是( )
A. 氧化还原反应的本质是化合价发生了变化 B. 化合价升高的物质被氧化
C. 得到电子的物质被氧化 D. 氧化还原反应中,先有氧化后有还原
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是
A. 无色溶液中:Na+、 Cl-、 SO42-、 Cu2+
B. 使紫色石蕊溶液变红的溶液中:Na+、Ca2+、C032-、Cl
C. 含SO42-的溶液中:K+、Ba2+、CI-、Br-
D. 酸性溶液中:Na+、SO42-、Cl-、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA为阿伏加德罗常数,已知某元素的阴离子Rn﹣的原子核中,中子数为A﹣x+n,其中A为原子的质量数,则m g Rn﹣中电子总数为( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题;(回答问题时,均需使用元素的真实元素符号,不得使用数字编号)
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)②、⑤、⑥的旅子半径由大到小的顺序为
(2)写出由①、②两元称组成,且①的质量分数最高的分子的电子式 , 写出该化合物跟⑧的单质发生置换反应的化学方程式 .
(3)元素⑥的最高价氧化物可和元素⑤的氢氧化物水溶液发生反应,写出反应的离子方程式
(4)元素③有多种氧化物,其中甲的相对分子质量最小;元素④有多种单质,其中乙的相对分子质量最小.在一定条件下,将2L 甲气体与1.5L 乙气体均匀混合,若该混合气体被足量NaOH 溶液完全吸收(没有气体残留).所生成的含氧酸盐的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 金属氧化物一定是碱性氧化物
B. 非金属氧化物一定是酸性氧化物
C. 酸性氧化物一定是非金属氧化物
D. 碱性氧化物一定是金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50molL﹣1盐酸与50mL0.55molL﹣1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: 
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)在实验过程中,该同学需要测定并记录的实验数据有(填序号).
A.盐酸的浓度
B.盐酸的温度
C.氢氧化钠溶液的浓度
D.氢氧化钠溶液的温度
E.水的比热容
F.反应后混合溶液的终止温度
(3)中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的比热容为4.18J/(g℃),酸与碱溶液的密度均为1g/cm3 . 通过计算可得中和热△H=
(4)实验中改用60mL0.50molL﹣1盐酸跟50mL0.55molL﹣1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷( ![]() )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: 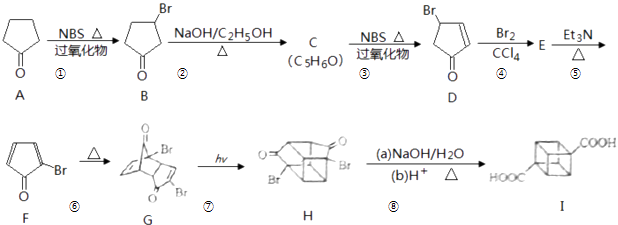
回答下列问题:
(1)C的结构简式为 , E的结构简式为 .
(2)③的反应类型为 , ⑤的反应类型为 .
(3)化合物A可由环戊烷经三步反应合成:![]()
反应I的试剂与条件为,反应2的化学方程式为 , 反应3可用的试剂为 .
(4)在I的合成路线中,互为同分异构体的化合物是 . (填化合物代号)
(5)I与碱石灰共热可化为立方烷.立方烷的核磁共振氢谱中有个峰.
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( ) 
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):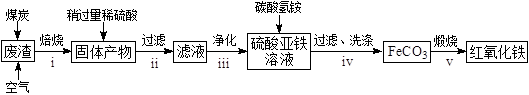
回答下列问题:
①在步骤i中产生的有毒气体可能有。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×1032 , 此时理论上将Al3+沉淀完全,则溶液的pH为。
③步骤iv中,生成FeCO3的离子方程式是。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
复分解反应ii的离子方程式是。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN , 方案如下:![]()
若试纸变蓝则证明食品中含有CN , 请解释检测时试纸中FeSO4的作用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com