
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( ) 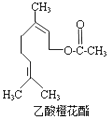
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
A.①②③
B.①②⑤
C.②④⑥
D.②⑤⑥
【答案】C
【解析】解:①根据结构简式知,分子式为C12H20O2 , 故正确;②含有碳碳双键,所以能被酸性高锰酸钾溶液氧化而使酸性KMnO4溶液褪色,能和溴发生加成反应而使溴水褪色,故错误;
③该分子中含有碳碳双键、酯基,具有烯烃和酯的性质,能发生氧化反应、加成反应、加聚反应、水解反应、取代反应,故正确;
④乙酸橙花酯的不饱和度为3,而芳香族化合物至少含有一个苯环,不饱和度至少为4,不存在属于芳香族化合物的同分异构体,故错误;
⑤1mol该有机物水解只能生成1mol羧基,所以只能消耗1molNaOH,故正确;
⑥该分子中含有两个碳碳双键能与氢气发生加成反应,酯基不能与氢气发生加成反应,所以1mol该有机物在一定条件下和H2反应,共消耗H2为2mol,故错误;
故选C.
【考点精析】掌握有机物的结构和性质是解答本题的根本,需要知道有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列数据中合理的是
A.用10 mL量筒量取7.13 mL稀盐酸
B.用托盘天平称量25.20 g NaCl
C.用广范pH试纸测得某溶液的pH为2.3
D.用25 mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示: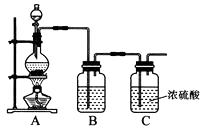
①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为。
②实验室制Cl2时,装置B中盛放的试剂为 , 其作用是。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。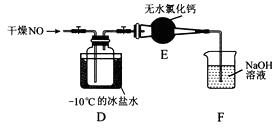
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为。
②装置D中的现象为。
③装置E中无水氯化钙的作用为。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是。
(3)NO可用间接电化学法除去,其原理如下图所示:
①阴极的电极反应式为。
②吸收塔内发生反应的离子方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列有关物质用途的叙述不正确的是()
A.明矾可用作净水剂B.NH4HCO3可用作氮肥
C.FeCl3溶液可用于腐蚀印刷电路板D.NaOH可用于治疗胃酸过多的疾病
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热△H
B.HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和NH3H2O反应的中和热△H=2×(﹣57.3)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)的△H=+2×283.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥蒸发,一定要用到玻璃棒的是( )
A. ①②⑥B. ②③⑥C. ③④⑥D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A. 电泳现象可证明胶体带电荷
B. 直径在1~100nm之间的粒子称为胶体
C. 是否具有丁达尔效应是区分溶液、胶体和浊液的依据
D. 胶体粒子很小,可以透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( ) 
A.图中的两条曲线,X表示NO2浓度随时间的变化曲线
B.前10 min内用v(N2O4)=0.02 mol/(Lmin)
C.25 min时,NO2转变为N2O4的反应速率增大,其原 因是将密闭容器的体积缩小为1L
D.该温度下反应的平衡常数 K=1.11 L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体K3[Fe(C2O4)3]3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究.该小组同学查阅资料知,固体产物中铁元素不可能以三价形式存在,而盐只有K2CO3 , 产生的气体中含有CO、CO2 . 请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.
限选试剂:①蒸馏水 ②3%H2O2溶液 ③氧化铜 ④1.0 molL﹣1盐酸⑤浓硫酸⑥1.0 molL﹣1NaOH溶液 ⑦澄清石灰水 ⑧0.5 molL﹣1 CuSO4溶液 ⑨2%KSCN溶液 ⑩苯酚溶液
(1)若用一套连续实验装置检验气体产物中CO的存在,并验证检验过程中有CO2生成,应选用的试剂为(按先后顺序把所选试剂的标号填入空格内)
(2)提出合理假设假设1:只有Fe; 假设2:只有FeO; 假设3: .
(3)设计实验方案并实验验证步骤1:取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体.
步骤2:取少量上述不溶固体放入试管中,加入足量溶液,充分振荡.若固体无明显变化,则假设成立;若有暗红色固体生成,则反应的离子方程式为 .
步骤3:取步骤2所得暗红色固体于试管中,滴加过量 , 振荡后静置.若溶液基本无色,则假设成立;若溶液呈 , 则假设3成立.
(4)问题讨论若固体产物中FeO含量较少,用步骤3方法难以确定.请你设计实验方案证明假设3成立(写出实验的操作步骤、现象与结论): .
(5)拓展与延伸有资料介绍“在含Fe2+的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”.假设溶液中的+3价铁还能被氯水氧化为更高价的QUOTE,试写出该反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com