
����Ŀ��(1)����ʵ�鷽����������________��
A���ü��ȷ���ȥ̼���ƹ����е�̼������
B������ı���ˮ��Һ�еĵ���ȡ���������þƾ�������ȡ
C��ʵ������ȡAl(OH)3����AlCl3��Һ�м���NaOH��Һ������
D����FeCl2��Һ�е���KSCN��Һ������FeCl2�Ƿ�����������
(2)ij�о���ѧϰС��Ϊ�о������Ƿ����Ư���ԣ������ͼ��ʾʵ��װ�á��Ը���ʵ��װ�ûش��������⣺

A��C��Ϊ�������ɫ������BΪ��ɫҺ�壬D��ΪNaOH��Һ��
�� �ڳ����£�KMnO4���������Ũ���ᷴӦ�����������䷴Ӧ����ʽΪ2KMnO4��16HCl(Ũ)===2KCl��2MnCl2��5Cl2����8H2O�����䷴Ӧװ��Ӧѡ�üס��ҡ����е�________��
�� B�е�Һ��Ϊ____________��������Ϊ_________________________________��
�� A��C����ɫ��������ɫ�仯�ֱ�Ϊ__________________________________��A��C��ʵ������˵�������Ƿ����Ư���ԣ�________(��ǡ���)��
�� D��NaOH��Һ��������_______________________(�����ӷ���ʽ˵��)��
�� ������������ͨ����з�̪��NaOH��Һ�У���Һ��ɫ��ȥ��С�����мס������������
�ף���������ˮ����Һ�����ԣ��к���NaOH��ʹ��Һ��Ϊ��ɫ��
�ң���������ˮ����Ư�������ʣ�ʹ��Һ��Ϊ��ɫ��
��ͬѧ����ɫ�����Һ������������NaOH��Һ����Һһֱδ����ɫ���� ________(��ס����ҡ�)�������ȷ��
���𰸡� AD �� Ũ���� �������������������е�ˮ���� A����ɫ������ɫ��C����ɫ��������ɫ �� Cl2��2OH��===Cl����ClO����H2O ��
����������1��A��̼�����Ƽ��ȷֽ�����̼���ơ�ˮ�Ͷ�����̼�������ü��ȷ���ȥ̼���ƹ����е�̼��������A��ȷ��B���ƾ���ˮ���ܣ����ܽ���ı���ˮ��Һ�еĵ���ȡ������B����C�����������������������������ǿ����Һ�У�ʵ������ȡAl(OH)3��Ӧ����AlCl3��Һ�м��백ˮ��������C����D���Ȼ������ױ�����Ϊ�Ȼ�����������FeCl2��Һ�е���KSCN��Һ�����Լ���FeCl2�Ƿ�������������D��ȷ����ѡAD����2���ٸ�����ع����Ũ���ᷴӦ�Ʊ���������Ӧ����Ҫ���ȣ�Ϊ������Һ�巴Ӧ��������������ˮ����װ�������ڹ����Һ������Ʊ����壬��װ�������ڹ����Һ�巴Ӧ��Ҫ�����������ˮ�����ɵ�����������ˮ����װ���ʺϣ���ѡ������Ũ���������ˮ�ԣ���Ũ�������������Ӧ������Bװ���е��Լ���Ũ���ᣬŨ����������Ǹ����������۸�����ع����Ũ���ᷴӦ���ɵ���������ˮ����������A�У�������ˮ������Ӧ��������ʹ����ᣬHClO��Ư���ԣ�A����ɫ������ɫ��B��Ũ���������ˮ�Ը���������������������ʹ��ɫ������ɫ������C����ɫ��������ɫ��A��C��ʵ��������˵����������Ư�������������ж�����Ҫβ����������D��NaOH��Һ��������������������ֹ��Ⱦ��������Ӧ�����ӷ���ʽΪCl2��2OH����Cl����ClO����H2O����������ɫ�����Һ������������NaOH��Һ������Һ���з�̪��������ҺӦ�Ժ�ɫ����Һһֱδ����ɫ��˵����������ˮ����Ư�������ʣ�ʹ��Һ��Ϊ��ɫ���������ڼ�к���ɫ��������ȷ��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д� ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɵ���A�뻯����B���ַ�ĩ��ɵĻ����, ��һ�������¿ɰ���ͼ��ʾ����ת��:
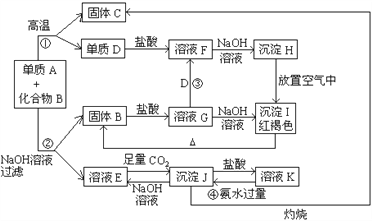
��ش�
��1��A�Ļ�ѧʽ____________; B�Ļ�ѧʽ_____________
��2����Ӧ�ٵĻ�ѧ����ʽ_____________________________________________
��3��������ҺF�������ӵķ�����_________________________________
��4����Ӧ�۵����ӷ���ʽ_____________________________________________
��5����Ӧ�ܵ����ӷ���ʽ_____________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��CaCO3��s���TCaO+CO2��g����H=+177.7kJ
��C��s��+H2O��s���TCO��g��+H2��g����H=��131.3kJmol��1
�� ![]() H2SO4��1��+NaOH��1���T
H2SO4��1��+NaOH��1���T ![]() Na2SO4��1��+H2O��1����H=��57.3kJmol��1
Na2SO4��1��+H2O��1����H=��57.3kJmol��1
��C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
��CO��g��+ ![]() O2��g���TCO2��g����H=��283kJmol��1
O2��g���TCO2��g����H=��283kJmol��1
��HNO3��aq��+NaOH��aq���TNaNO3��aq��+H2O��1����H=��57.3kJmol��1
��2H2��g��+O2��g���T2H2O��1����H=��517.6kJmol��1
��1�������Ȼ�ѧ����ʽ�У�����ȷ���� �� ����ȷ�����ɷֱ���
��2������������Ϣ��д��Cת��ΪCO���Ȼ�ѧ����ʽ�� ��
��3��������Ӧ�У���ʾȼ���ȵ��Ȼ�ѧ����ʽ������ʾ�к��ȵ��Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2003�꣬ȫ�����������صķǵ��ͷ������飬����Һһʱ��Ϊ������Ʒ����84������Һ�����������������̱�ע�����ٱ�ƷΪ��ɫҺ�壬�ʼ��ԣ���ʹ��ʱ��ˮϡ�ͣ��ۿɶԲ;ߡ�������������Ư��dzɫ�������Ч�ɷ��ǣ�����
A.CH3CH2OH
B.KMnO4
C.NaClO
D.C6H5OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҴӸɺ�������ȡ��IJ��������У�����ѡ�ô������
A. ���ոɺ�����������
B. ���˺���������Һ��������©��
C. �ӵ�ˮ����ȡ�⩁����Һ©��
D. ���������Ȼ�̼����������ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͪ����ͼ1����һ����Ҫ�Ļ���ԭ�ϣ�ʵ���ҳ�������ԭ����װ���Ʊ������ּг�����δ����������ͼ2����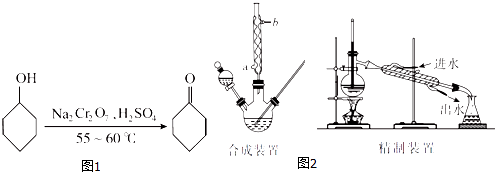
������������ͪ��ˮ�IJ����������ʼ��±���*�����е����ݱ�ʾ���л�����ˮ�γɵľ��й̶���ɵĻ����ķе㣩��
���� | ��Է������� | �е㣨�棩 | �ܶȣ�gcm��3 �� 20�棩 | �ܽ��� |
������ | 100 | 161.1��97.8�� | 0.9624 | ������ˮ |
����ͪ | 98 | 155.6��95�� | 0.9478 | ����ˮ |
ˮ | 18 | 100.0 | 0.9982 |
��1����֪�ϳɻ���ͪ�ķ�Ӧ�Ƿ��ȷ�Ӧ����Ӧ���ҽ�������ϵ�¶�Ѹ������������Ӧ���࣮ʵ��ʱ�����ںϳ�װ���м���5.2 mL��5 g���������ͼ�����ʯ���ټ�������Na2Cr2O7��Һ������Na2Cr2O7��Һ�ļ��Ϸ�ʽΪ������ţ���
A.һ���Լ���
B.��������
C.����ν���������붼����
��2��������Na2Cr2O7��Һ�����Ϊ35 mL����Ӧѡȡ���100 mL����250mL����������ƿ��
��3����Ӧ��ɺ�������ˮ�������ռ�95��100�����֣���ΪA��������Ҫ�ɷ����Ļ���
��4���ϳ�װ���������ܵ������� �� ����ˮ�������ܵ����a����b�����ڽ��룮
��5�������A�м����Ȼ��ƹ��������ͣ������á���Һ�����л��㣨��ΪB���������Ȼ��ƹ���������� ��
��6�����л���B�м�����ˮ����þ���壬��ȥ���е�����ˮ�֣����ˣ�����Һ���ھ���װ���������ռ�������ţ�����֣��õ������Ļ���ͪ��
A.100.0��102.0��
B.154.0��156.0��
C.160.0��162.0��
��7������װ���еĴ����� �� ����дһ�㣩
��8�������յõ�����ͪ������Ϊ3.43 g����ͪ�IJ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦmA��g��nB��g��+pC��s����H=Q���¶Ⱥ�ѹǿ�ı仯�������淴Ӧ���ʵ�Ӱ��ֱ����ͼ�е�����ͼ������������ȷ���ǣ� �� 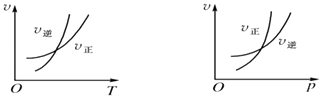
A.m��n��Q��0
B.m��n+p��Q��0
C.m��n��Q��0
D.m��n+p��Q��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��������ʵ���������ȷ����
A.��ά���Ǹ߷��ӻ�����
B.�����µ�����Һ���ⵥ�ʱ���
C.��������C��H��N����Ԫ����ɵ�
D.���۳���ʳ���⣬��Ҫ�������������Ǻ;ƾ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������з�����ɫ��չ�����ÿɳ�����չ�������й�����
��1������һ����Ҫ����ԭ�ϣ��ϳɰ�ԭ����H2 �� ������Ȼ��Ϊԭ���Ƶã��йط�Ӧ�����仯��ͼ1��ʾ������CH4��g����H20��g����Ӧ�Ƶ�H2��g����CO��g�����Ȼ�ѧ����ʽΪ��
��2���������������Ź㷺��;�����ǻ�������Ⱦ���i����150��ʱ����0.4mol NO2����������Ϊ2L������ܱ������У�������Ӧ��2NO2��g��N2O4��g����
ÿ��һ��ʱ��ⶨ�����ڸ����ʵ����ʵ������������±���
ʱ��/S | 0 | 20 | 40 | 60 | 80 |
N��NO2��/mol | 0.4 | n1 | 0.26 | n3 | n4 |
N��N2O4��/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
�ٵ���Ӧ��150��ﵽƽ��ʱ���÷�Ӧƽ�ⳣ��K= �� ������ֵ��
�������ͨ��N2O4 �� ����ͬ�����´ﵽƽ��ʱ��������Ũ����Ȼ��ͬ����N2O4����ʼŨ��
ӦΪ ��
��ii����������HNO3��β���к���NO��NO2 �� ��n��NO����n��NO2��=1��1������������Һ��ȥ��������ԭ���ǣ�NO2��NO��ˮ��Ӧ���������ᣬ��������������[CO�� NH2��2]��Ӧ���ɶԻ�������
Ⱦ�����ʣ�����1mol�������ո�β�����������յ�������g��
��3��������CO2��һ�������¿ɺϳ����أ��䷴ӦΪ��2NH3��g��+CO2��g���TCO��NH2��2��s��+H2O��g��ͼ2��ʾ�ϳ����а�̼��a��CO2ת���ʦصĹ�ϵ��aΪ[n��NH3����n��CO2��]��bΪˮ̼��[n��H2O����n��CO2��]����
��bӦ��������
A.1.5��1.6 B.1��1.1 C.0.6��0.7
��aӦ������4.0�������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com