
【题目】由单质A与化合物B两种粉末组成的混合物, 在一定条件下可按下图所示发生转化:
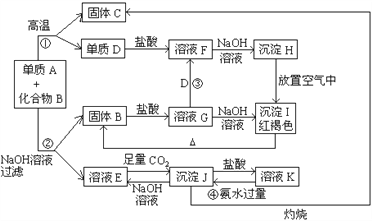
请回答:
(1)A的化学式____________; B的化学式_____________
(2)反应①的化学方程式_____________________________________________
(3)检验溶液F中阳离子的方法是_________________________________
(4)反应③的离子方程式_____________________________________________
(5)反应④的离子方程式_____________________________________________
【答案】 Al Fe2O3 2Al+Fe2O3=2Fe+Al2O3 加KSCN溶液不变红色,加氯水变红色(或其他合理答案) 2Fe3++Fe=3Fe2+ Al3++3NH·H2O=Al(OH)3↓+3NH4+
【解析】第一个“突破口”是红褐色沉淀I为Fe(OH)3,沉淀H置于空气中变成I,推出H为Fe(OH)2,再利用其他信息和逆向推理得出D为Fe,F为FeCl2,B为Fe2O3,G为FeCl3;第二个“突破口”是利用E、J、K之间的转化关系,结合有关知识和直觉判断E为NaAlO2,J为Al(OH)3,K为AlCl3,最后推出A、B、C。
(1)正确答案:Al;Fe2O3;
(2)铝和氧化铁加热条件下发生置换反应生成氧化铝和铁;正确答案:2Al+Fe2O3=2Fe+Al2O3
(3)Fe2+的检验方法:加入氢氧化钠溶液,生成白色沉淀变为灰绿色,最后变为红褐色;或者加KSCN溶液不变红色,加氯水变红色溶液;正确答案:加KSCN溶液不变红色,加氯水变红色;(或其他合理答案)
(4)Fe3+被Fe还原为Fe2+ ;正确答案:2Fe3++Fe=3Fe2+;
(5)氢氧化铝沉淀不溶于过量的氨水;正确答案:Al3++3NH·H2O=Al(OH)3↓+3NH4+;


科目:高中化学 来源: 题型:
【题目】已知化学反应C(s)+O2(g) ![]() CO2(g)、2CO(g)+O2(g)
CO2(g)、2CO(g)+O2(g) ![]() 2CO2(g)都是放热反应,据此判断,下列说法错误的是( )
2CO2(g)都是放热反应,据此判断,下列说法错误的是( )
A.12gC所具有的能量一定高于28gCO所具有的能量
B.56gCO和32gO2所具有的总能量大于44gCO2所具有的总能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水养金鱼时,通常先将自来水日晒一段时间后,再注入鱼缸。其目的是()
A.利用紫外线杀死水中的细菌
B.提高水温,有利金鱼生长
C.增加水中氧气的含量
D.促使水中的次氯酸分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质露置在空气中易变质的是()
①漂白粉②苯酚③水玻璃④硫酸钠⑤烧碱⑥亚硫酸钠⑦胆矾⑧硬化油⑨Vc
A.除④⑦⑧外
B.除④⑦外
C.除⑥⑦⑧外
D.全部易变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的最的气体A和B,一定温度下发生反应:A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示.下列说法中正确是( )
A.8min时表示正反应速率等于逆反应速率
B.前20minA的反应速率为0.05mol/(Lmin)
C.反应方程式中的x=1,30min时表示增大压强
D.40min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1774年瑞典化学家舍勒用软锰矿(主要成分是二氧化锰)和盐酸共热得到黄绿色气体.甲、乙两个同学分别采取上述反应原理,各制取一瓶氯气,并用其验证Cl2与水反应所得产物的性质.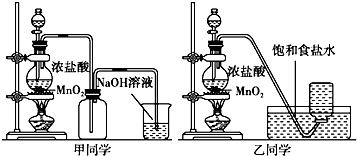
请回答:
(1)写出实验室制备氯气的化学方程式 .
(2)对于乙同学的实验装置,若要停止实验,其操作顺序是 . ①停止加热 ②取出集气瓶盖好 ③将导管伸入到烧碱溶液中
(3)甲、乙两同学分别向收集到的氯气中加入适量水,充分振荡后分成两份,均做验证氯气与水反应所得产物性质的两个实验.实验操作、现象、结论记录如下:
实验序号 | 实验操作 | 现象 | 结论 |
① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
② | 加入NaHCO2粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你填写下表评价甲、乙同学实验①、②的结论(填合理或不合理)
实验序号 | 甲 | 乙 |
① | ||
② |
(4)丙同学查阅资料发现HClO的氧化性大于MnO2 , 拟用下列四组试剂在实验室制取氧气A.CaC12和次氯酸B.浓盐酸NaClO
C.浓盐酸和次氯酸 D.固体NaCl、固体NaClO和浓硫酸
你认为上述四种试剂中组试剂符合实际,且Cl的原子利用率最高.试写出这个反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l),下列说法正确的是( )
2PbSO4(s)+2H2O(l),下列说法正确的是( )
A.放电时,负极的电极反应式为:Pb﹣2e﹣═Pb2+
B.放电时,正极得电子的物质是PbO2
C.充电时,电解质溶液中硫酸浓度减小
D.充电时,阴极的电极反应式为:PbSO4﹣2e﹣+2H2O═PbO2+4H++SO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列实验方法合理的是________。
A.用加热法除去碳酸钠固体中的碳酸氢钠
B.将碘的饱和水溶液中的碘提取出来,可用酒精进行萃取
C.实验室制取Al(OH)3:向AlCl3溶液中加入NaOH溶液至过量
D.向FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质
(2)某研究性学习小组为研究氯气是否具有漂白性,设计如图所示实验装置。试根据实验装置回答下列问题:

A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液。
① 在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的________。
② B中的液体为____________,其作用为_________________________________。
③ A、C中有色布条的颜色变化分别为__________________________________,A、C的实验现象说明氯气是否具有漂白性?________(填“是”或“否”)。
④ D中NaOH溶液的作用是_______________________(用离子方程式说明)。
⑤ 将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去。小组内有甲、乙两种意见:
甲:氯气溶于水后溶液显酸性,中和了NaOH,使溶液褪为无色;
乙:氯气溶于水生成漂白性物质,使溶液褪为无色。
丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则 ________(填“甲”或“乙”)的意见正确。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com