
【题目】铅蓄电池反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l),下列说法正确的是( )
2PbSO4(s)+2H2O(l),下列说法正确的是( )
A.放电时,负极的电极反应式为:Pb﹣2e﹣═Pb2+
B.放电时,正极得电子的物质是PbO2
C.充电时,电解质溶液中硫酸浓度减小
D.充电时,阴极的电极反应式为:PbSO4﹣2e﹣+2H2O═PbO2+4H++SO ![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】2L容器中,分别将物质的量均为2.00mol的SO2、O2混合,在不同温度(T)下发生如下反应:2SO2(g)+O2(g)2SO3(g).并在第10s时分别测定其中SO3的体积分数(SO3%)并绘成如图所示曲线:则下列说法正确的是( ) 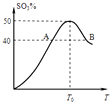
A.此反应的正反应为吸热反应
B.A,B两点正反应速率的大小关系是:vA>vB
C.以O2表示T0对应的平均反应速率 ![]() (O2)=0.04 mol/(L?s)
(O2)=0.04 mol/(L?s)
D.温度T<T0时,温度升高,平衡向正反应方向移动,所以SO3%逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由单质A与化合物B两种粉末组成的混合物, 在一定条件下可按下图所示发生转化:
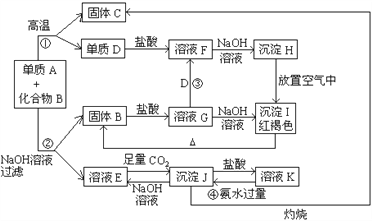
请回答:
(1)A的化学式____________; B的化学式_____________
(2)反应①的化学方程式_____________________________________________
(3)检验溶液F中阳离子的方法是_________________________________
(4)反应③的离子方程式_____________________________________________
(5)反应④的离子方程式_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 金属氧化物一定是碱性氧化物
B. 非金属氧化物一定是酸性氧化物
C. 酸性氧化物一定是非金属氧化物
D. 碱性氧化物一定是金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(1)真空碳热还原﹣氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)═6AlCl(g)+6CO(g)△H=akJmol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJmol﹣1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=kJmol﹣1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)= , T1℃时,该反应的平衡常数K=;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的NO
b.加入一定量的活性炭
c.加入合适的催化剂
d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q0(填“>”或“<”).
④在绝热恒容条件下,能判断该反应一定达到化学平衡状态的依据是(填选项编号).
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷( ![]() )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: 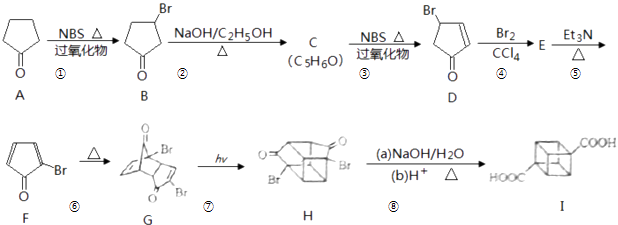
回答下列问题:
(1)C的结构简式为 , E的结构简式为 .
(2)③的反应类型为 , ⑤的反应类型为 .
(3)化合物A可由环戊烷经三步反应合成:![]()
反应I的试剂与条件为,反应2的化学方程式为 , 反应3可用的试剂为 .
(4)在I的合成路线中,互为同分异构体的化合物是 . (填化合物代号)
(5)I与碱石灰共热可化为立方烷.立方烷的核磁共振氢谱中有个峰.
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CaCO3(s)═CaO+CO2(g)△H=+177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=﹣131.3kJmol﹣1
③ ![]() H2SO4(1)+NaOH(1)═
H2SO4(1)+NaOH(1)═ ![]() Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
⑤CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283kJmol﹣1
O2(g)═CO2(g)△H=﹣283kJmol﹣1
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1)△H=﹣57.3kJmol﹣1
⑦2H2(g)+O2(g)═2H2O(1)△H=﹣517.6kJmol﹣1
(1)上述热化学方程式中,不正确的有 , 不正确的理由分别是
(2)根据上述信息,写出C转化为CO的热化学方程式: .
(3)上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2003年,全国发生了严重的非典型肺炎疫情,消毒液一时成为抢购商品。“84”消毒液是市售主力军,其商标注明:①本品为无色液体,呈碱性,②使用时加水稀释,③可对餐具、衣物消毒,可漂白浅色衣物。其有效成分是()。
A.CH3CH2OH
B.KMnO4
C.NaClO
D.C6H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类物质的叙述不正确的是
A.纤维素是高分子化合物
B.常温下淀粉溶液遇碘单质变蓝
C.糖类是由C、H、N三种元素组成的
D.淀粉除做食物外,主要用来生产葡萄糖和酒精
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com