
【题目】碘及其化合物在合成杀菌剂、药物、化学研究等方面具有广泛用途。
(1)为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL0.5mol·L-1 KI溶液,向其中加入0.1 mol·L-1FeCl3溶液1 mL,充分反应。下列实验操作能验证该反应是否存在限度的是___。
A.再滴加AgNO3溶液,观察是否有黄色沉淀产生
B.再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C.再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生
D.再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成血红色
(2)已知1molH2(g)、1molI2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436kJ、151kJ、 300kJ的能量,则氢气和碘蒸气反应生成HI气体的热化学方程式为_____。
(3)Bodensteins研究了下列反应:2HI(g)![]() H2(g) +I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:
H2(g) +I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 |
n(HI) | 1 | 0.91 | n |
0min到20min HI的平均反应速率为_______;
反应到达40min时,剩余HI 的物质的量____0.82mol(填“﹥” “﹤”或“=”)。
【答案】D H2(g)+I2(g)=2HI(g) △H=-13kJ/mol 0.00225mol·L-1·min-1 >
【解析】
根据可逆反应的特征分析反应是否存在反应限度;根据键能计算反应热;根据速率表达式计算反应平均速率;根据影响反应速率大小的因素分析解答。
(1)KI溶液和FeCl3溶液发生氧化还原反应生成Fe2+和I2,反应的离子方程式为2Fe3++2I-═2Fe2++I2,通过计算,I-过量;反应后的溶液中加入CCl4,如有机层呈紫红色,则说明生成碘,向含Fe3+的溶液中滴加几滴KSCN溶液呈血红色,就说明Fe3+没有反应完(或KI和FeCl3的反应有一定的限度);
A.无论是否存在反应限度,因为I-过量,滴加AgNO3溶液,都有黄色沉淀、白色沉淀生成,故A不选;
B.加入CCl4振荡后,观察下层液体颜色变为紫红色,只能说明生成碘,不能确定反应限度,故B不选;
C.因为溶液中Cl-不参加反应,取上层清液,滴加AgNO3溶液,肯定有白色沉淀,不能确定反应限度,故C不选;
D.取上层清液,滴加KSCN溶液,观察溶液是否变血红色,可知Fe3+有没有反应完,从而确定KI和FeCl3的反应有一定的限度,故D选;
(2)已知1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ;形成1molHI(g)分子需要释放300kJ的能量,则反应热为:436kJ+151kJ-300kJ×2=-13kJ,则氢气和碘蒸气反应生成HI气体的热化学方程式为:H2(g)+I2(g)=2HI(g)H=-13kJmol-1,故答案为:H2(g)+I2(g)=2HI(g)H=-13kJmol-1;
(3)v=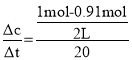 =0.00225molL-1min-1,所以后20min速率小于0.00225molL-1min-1,变化量小于0.09mol,剩余HI的物质的量>0.91-0.09mol=0.82mol,故答案为:0.00225molL-1min-1;大于。
=0.00225molL-1min-1,所以后20min速率小于0.00225molL-1min-1,变化量小于0.09mol,剩余HI的物质的量>0.91-0.09mol=0.82mol,故答案为:0.00225molL-1min-1;大于。


科目:高中化学 来源: 题型:
【题目】硝基苯是制造染料的重要原料,某同学在实验室里用如图所示装置制取硝基苯,主要步骤如下:

①在大试管里将2 mL浓硫酸和1.5 mL浓硝酸混合,摇匀,冷却到50~60 ℃以下;然后逐滴加入1 mL苯,边滴边振荡试管。
②按图连接好装置,将大试管放入60 ℃的水浴中加热10分钟。
完成下列填空:
(1)指出上图中的错误:__________、____________。
(2)向混合酸中加入苯时,“逐滴加入”“边滴边振荡试管”的目的是__________________________。
(3)反应一段时间后,混合液明显分为两层,上层主要物质是________(填物质名称)。把反应后的混合液倒入盛有冷水的烧杯里,搅拌,可以看到________(填字母)。
a.水面上是含有杂质的硝基苯
b.水底有苦杏仁味的液体
c.烧杯中的液态有机物只有硝基苯
d.有无色、油状液体浮在水面
(4)为了获得纯硝基苯,实验步骤:①水洗、分液;②将粗硝基苯转移到盛有__________的烧杯中洗涤、用__________(填仪器名称)进行分离;③__________;④干燥;⑤__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液态化合物AB会发生微弱的自身电离,电离方程式为AB![]() A++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是 ( )。
A++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是 ( )。
A.c(A+)随温度升高而降低
B.在35 ℃时,c(A+)>c(B-)
C.AB的电离程度(25 ℃)>(35 ℃)
D.AB的电离是吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度时,100 mL 0.01 mol/L的醋酸溶液与10mL 0.l mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A. 中和时所需NaOH的量 B. OH-的物质的量浓度
C. 与Mg反应的起始速率 D. 溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了一套实验分馏原油的五个步骤:
①将仪器a固定在铁架台上,在仪器a上塞好带温度计的橡皮塞。
②连接好冷凝管。把冷凝管固定在铁架台上,将冷凝管进水口的橡皮管的一端和水龙头连结,将和出水口相接的橡皮管的另一端放在水槽中。
③把酒精灯放在铁架台上,根据酒精灯高度确定铁圈的高度,放好石棉网。
④向仪器a中放入几片碎瓷片,再用漏斗向仪器a中加入原油,塞好带温度计的橡皮塞,把连接器连接在冷凝器的末端,并伸入接收装置(如锥形瓶)中。
⑤检查气密性(利用给固定装置微热的方法)。请完成以下题目:

(1)上述实验正确的操作顺序是:_______(填序号)。
(2)仪器a的名称为:______。
(3)冷凝管里水流的方向为____进____出。(填f或g,注:上为f下为g)。
(4)分馏原油是利用了原油中各组分的______不同而达到分离的目的。
(5)仪器a中放几片碎瓷片的目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积不变的密闭容器中,进行如下可逆反应:C(s)+CO2(g)![]() 2CO(g)下列能表明该反应已达到平衡状态的是
2CO(g)下列能表明该反应已达到平衡状态的是
①2v(CO2)=v(CO) ②2n(CO2)=n(CO)
③2v正(C)=v逆(CO) ④混合气体的密度保持不变
⑤混合气体的平均摩尔质量
A. ④ B. ④⑤ C. ①④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能与酸性KMnO4溶液反应,又能与溴水反应的是
①乙烷 ②1,3-丁二烯 ③苯 ④丙烯 ⑤邻二甲苯
A. ①② B. ②④
C. ①②④⑤ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com