
【题目】下列关于结构式的叙述中正确的是
A. 表示组成分子中的各原子在空间的位置
B. 以共价键相连的两原子间总以一条短线相连
C. 结构式和球棍模型在表示分子结构上作用相同
D. 用一条短线表示一对共用电子对的图式反映共价分子中各原子的连接顺序
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合液,经测定ClO﹣和ClO3﹣的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为( )
A.21:5
B.11:3
C.3:1
D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨水和盐酸是常见的化学试剂,可将氨气(NH3)、氯化氢气体分别溶于水制得. 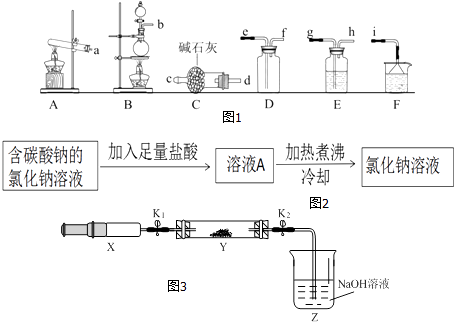
(1)氨气的发生装置可以选择如图1中的 , 反应的化学方程式为 .
(2)欲收集一瓶干燥的氨气,选择如图中的装置,其连接顺序为:发生装置→(按气流方向,用小写字母表示).
(3)小华为探究氨气溶于水是否发生化学反应,设计并完成如表实验(填写表中空白):
实验操作 | 实验现象及结论 |
将浸有酚酞溶液的滤纸干燥后,放入盛有干燥氨气的集气瓶中 | 无明显现象 |
(4)小明将滴有酚酞的稀氨水加热,观察到溶液颜色变浅,原因可能是 .
(5)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化.为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①>②,则稀盐酸经加热煮沸后浓度(填“增大”、“减小”或“不变”).为除去氯化钠溶液中的碳酸钠,小林设计了如图2方案:
你认为上述方案(填“合理”或“不合理”),请分析:(如合理,说明原因;如不合理,说明原因并设计改进方案).
(6)为研究氨气的还原性,小兰做了一下实验:
将(2)收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度如图3所示装置进行实验.
操作步骤 | 实验现象 | 解释原因 |
打开K1 , 推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法中不符合“绿色化学”思想的是( )
A.以水性涂料代替油性涂料
B.以无磷洗涤剂代替含磷洗涤剂
C.实验后的有毒有害物质应分类收集、统一处理
D.在通风橱中制氯气时不用NaOH溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.02 mol·L-1的盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的溶液中c(Ag+)与pH分别为
A. 1.8×10-7mol·L-1,2 B. 1.8×10-8mol·L-1,2
C. 1.8×10-7mol·L-1,3 D. 1.8×10-8mol·L-1,3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示,请回答下列问题:

(1)电极X的材料是:________(填化学式);电解质溶液Y是:_________;
(2)银电极为电池的_______极,发生的电极反应为:___________________,X电极上发生的电极反应为:_____________________________________;
(3)外电路中的电子是从_________电极流出(填“X”或“银”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组固体混合物分离操作正确的是
A. 碳酸钠和碳酸钙:溶解、过滤、蒸发(结晶)
B. 氯化钠和硫酸钠:溶解、过滤、蒸发(结晶)
C. 石灰石和氧化铁:溶解、过滤、蒸发(结晶)
D. 生石灰和碳酸钠:溶解、过滤、蒸发(结晶)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3,又名三氯化铁,是黑棕色结晶,主要用于金属蚀刻,污水处理。解答下列问题。
(1)按照物质的分类方法,FeCl3应属于_______________________。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥电解质 ⑦易溶于水物质
A.②③④⑤⑥⑦ B.①④⑥⑦ C.②④⑤⑥⑦ D.④⑤⑥⑦
(2)0.1mol/LFeCl3溶液中c(Cl-)=_______mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,则此溶液中c(Fe3+) =_______mol/L.
(3)将饱和FeCl3溶液逐滴加入沸水中,继续煮沸可制取氢氧化铁胶体,氢氧化铁胶体可处理污水,该反应的化学方程式为__________________;高铁酸钠Na2FeO4是一种新型水处理剂,用FeCl3制备的离子方程式如下,请完成该方程式的配平:___Fe3++_____Cl 2+_____OH-=_____FeO42-+_____Cl-+_____H2O
(4)FeCl3还可用于有机物的鉴别,已知芳香族化合物A、B、C的分子式均为C7H8O
A | B | C | |
加入氯化铁溶液 | 显紫色 | 无明显现象 | 无明显现象 |
加入钠 | 放出氢气 | 放出氢气 | 不反应 |
苯环上一氯代物的种数 | 2 | 3 | 3 |
则B的结构简式为____,A与浓溴水反应的方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为原子序数递增的四种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(关系图中“—”相连的两种物质能发生反应)。下列判断正确的是
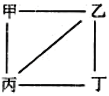
A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族
C. 四种原子中,Y原子半径最小 D. W的简单阴离子可能促进水的电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com