
ЁОЬтФПЁПвдЪГбЮЮЊдСЯНјааЩњВњВЂзлКЯРћгУЕФФГаЉЙ§ГЬШчЭМЃК
ЃЈ1ЃЉГ§ШЅДжбЮжаЕФЮЂШмЮяжЪCaSO4ЭЈГЃгУNa2CO3ДІРэЃЌЧыгУЦНКтвЦЖЏдРэНтЪЭЫЕУїЃК____ЁЃ
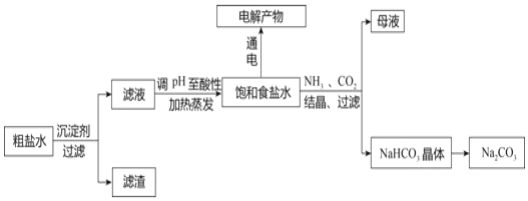
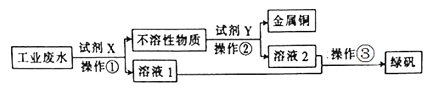
ЃЈ2ЃЉШЫУЧЯАЙпЩЯАбЕчНтБЅКЭЪГбЮЫЎЕФЙЄвЕНазіТШМюЙЄвЕЁЃЭМ1БэЪОЕчНтБЅКЭNaClШмвКЕФзАжУЃЌXЁЂYЪЧЪЏФЋАєЁЃЪЕбщПЊЪМЪБЃЌдкСНБпЭЌЪБИїЕЮШыМИЕЮЗгЬЊШмвКЃЌЧыЛиД№вдЯТЮЪЬтЃК
МьбщYЕчМЋЗДгІВњЮяЕФЗНЗЈЪЧ_____ЁЃЕчНтNaClШмвКЕФРызгЗНГЬЪНЪЧ____ЁЃ
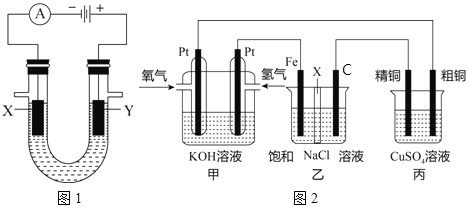
ЃЈ3ЃЉФГЭЌбЇЩшМЦвЛИіШМСЯЕчГи(ШчЭМ2ЫљЪО)ЃЌФПЕФЪЧЬНОПТШМюЙЄвЕдРэКЭДжЭЕФОЋСЖдРэЃЌЦфжаввзАжУжаXЮЊбєРызгНЛЛЛФЄЁЃИљОнвЊЧѓЛиД№ЯрЙиЮЪЬтЃК
ЂйЭЈШыЧтЦјЕчМЋЕФЗДгІЪНЮЊ____ЁЃ
ЂкЪЏФЋЕчМЋЮЊ_____(ЬюЁАбєМЋЁБЛђЁАвѕМЋЁБ)ЃЌЗДгІвЛЖЮЪБМфКѓЃЌдкввзАжУжаЕЮШыЗгЬЊШмвКЃЌ_____Чј(ЬюЁАЬњМЋЁБЛђЁАЪЏФЋМЋЁБ)ЕФШмвКЯШБфКьЁЃ
ЂлШчЙћДжЭжаКЌгааПЁЂвјЕШдгжЪЃЌБћзАжУжаЗДгІвЛЖЮЪБМфЃЌСђЫсЭШмвКХЈЖШНЋ____(ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ)ЁЃ
ЂмШєдкБъзМзДПіЯТЃЌга224mLбѕЦјВЮМгЗДгІЃЌдђввзАжУжаЬњЕчМЋЩЯЩњГЩЕФЦјЬхдкБъПіЯТЬхЛ§ЮЊ_____LЃЛБћзАжУжавѕМЋЮіГіЭЕФжЪСПЮЊ_____gЁЃ(ЭЕФФІЖћжЪСПЮЊ64)
ЁОД№АИЁПCaSO4ДцдкЯТСаЕФШмНтЦНКтЃКCaSO4(s)Ca2+(aq)+![]() (aq)ЃЌМгШыNa2CO3ШмвККѓЃЌ
(aq)ЃЌМгШыNa2CO3ШмвККѓЃЌ![]() гыCa2+НсКЯЃЌЩњГЩИќФбШмЕФCaCO3ГСЕэЃЛCa2+РызгХЈЖШМѕЩйЃЌЪЙЩЯЪіЦНКтЯђзХИќФбШмЕФЗНЯђвЦЖЏ НЋЪЊШѓЕФKIЕэЗлЪджНЗХдкЦјЬхГіПкЃЌШєЙлВьЕНЪджНБфРЖЃЌжЄУїгаCl2ВњЩњ 2Cl-+2H2O
гыCa2+НсКЯЃЌЩњГЩИќФбШмЕФCaCO3ГСЕэЃЛCa2+РызгХЈЖШМѕЩйЃЌЪЙЩЯЪіЦНКтЯђзХИќФбШмЕФЗНЯђвЦЖЏ НЋЪЊШѓЕФKIЕэЗлЪджНЗХдкЦјЬхГіПкЃЌШєЙлВьЕНЪджНБфРЖЃЌжЄУїгаCl2ВњЩњ 2Cl-+2H2O ![]() Cl2Ёќ+H2Ёќ+2OH- H2-2e-+2OH-ЈT2H2O бєМЋ ЬњМЋ МѕаЁ 0.448 1.28
Cl2Ёќ+H2Ёќ+2OH- H2-2e-+2OH-ЈT2H2O бєМЋ ЬњМЋ МѕаЁ 0.448 1.28
ЁОНтЮіЁП
СїГЬЭМДжбЮЫЎМгШыГСЕэМСГСЕэCa2+ЁЂMg2+КЭSO42-РызгЃЌЙ§ТЫЕУЕНЕФТЫвКЕїНкШмвКpHжСЫсадЃЌМгШШХЈЫѕЕУЕНБЅКЭТШЛЏФЦШмвКЃЌЕчНтБЅКЭЪГбЮЫЎЕУЕНЧтбѕЛЏФЦЁЂТШЦјКЭЧтЦјЃЌБЅКЭЪГбЮЫЎжаЭЈШыАБЦјЁЂЖўбѕЛЏЬМЕУЕНЬМЫсЧтФЦОЇЬхЃЌЬМЫсЧтФЦОЇЬхМгШШЗжНтЕУЕНЬМЫсФЦЁЃ
(1)Г§ШЅДжбЮжаЕФЮЂШмЮяжЪCaSO4ЭЈГЃгУNa2CO3ДІРэЃЌЦНКтвЦЖЏдРэНтЪЭЮЊЃКCaSO4ДцдкЯТСаЕФШмНтЦНКтЃКCaSO4(s)Ca2+(aq)+![]() (aq)ЃЌМгШыNa2CO3ШмвККѓЃЌ
(aq)ЃЌМгШыNa2CO3ШмвККѓЃЌ![]() РызггыCa2+НсКЯЩњГЩИќФбШмЕФCaCO3ГСЕэЃЛCa2+РызгХЈЖШМѕЩйЃЌЪЙЩЯЪіЦНКтЯђзХИќФбШмЕФЗНЯђвЦЖЏЃЛ
РызггыCa2+НсКЯЩњГЩИќФбШмЕФCaCO3ГСЕэЃЛCa2+РызгХЈЖШМѕЩйЃЌЪЙЩЯЪіЦНКтЯђзХИќФбШмЕФЗНЯђвЦЖЏЃЛ
(2)XЕчМЋЩЯЧтРызгЗХЕчЩњГЩЧтЦјЃЌYЕчМЋЩЯТШРызгЗХЕчЩњГЩТШЦјЃЌЕчМЋЗДгІЮЊ2Cl--2e-=Cl2ЁќЃЌТШЦјПЩвдгУЪЊШѓЕФЕэЗлЕтЛЏМиЪджНМьбщЃЌШчЙћЪЊШѓЕФЕэЗлЕтЛЏМиЪджНБфРЖЩЋЃЌдђжЄУїгаТШЦјЩњГЩЃЌЕчНтNaClШмвКЕФРызгЗНГЬЪНЮЊ2Cl-+2H2O![]() Cl2Ёќ+H2Ёќ+2OH-ЃЛ
Cl2Ёќ+H2Ёќ+2OH-ЃЛ
(3)ЂйШМСЯЕчГижаЃЌЭЈШыШМСЯЕФЕчМЋЪЧИКМЋЁЂЭЈШыбѕЛЏМСЕФЕчМЋЪЧе§МЋЃЌИКМЋЩЯЪЇЕчзгЗЂЩњбѕЛЏЗДгІЃЌЭЈШыЧтЦјЕчМЋЕФЗДгІЪНЮЊH2-2e-+2OH-ЈT2H2OЃЛ
ЂкЪЏФЋЕчМЋЮЊбєМЋЃЌЬњЕчМЋзївѕМЋЃЌвѕМЋЩЯЧтРызгЗХЕчЃЌЭЌЪБЕчМЋИННќгаЧтбѕИљРызгЩњГЩЃЌШмвКГЪМюадЃЌЮоЩЋЗгЬЊЪдвКдкЬњМЋИННќБфКьЩЋЃЛ
ЂлБћзАжУЮЊДжЭЕФЕчНтОЋСЖЃЌДПЭЮЊвѕМЋЃЌвѕМЋЩЯЭРызгЗХЕчЃЌЕчМЋЗДгІЮЊCu2++2e-ЈTCuЃЌШмНтЕФДжЭаЁгкЮіГіЕФЭжЪСПЃЌЕМжТШмвКжаСђЫсЭХЈЖШНЕЕЭЃЛ
ЂмДЎСЊЕчТЗжазЊвЦЕчзгЯрЕШЃЌЕБзЊвЦЯрЕШЕчзгЪБЯћКФбѕЦјЬхЛ§гыЩњГЩЧтЦјЬхЛ§жЎБШЮЊ1ЃК2ЃЌЫљвдЩњГЩЧтЦјЬхЛ§ЮЊ0.448LЃЛзЊвЦЕчзгЕФЮяжЪЕФСП=![]() =0.04molЃЌзЊвЦЕчзгЯрЕШЃЌдђЮіГіЭЕФжЪСП=
=0.04molЃЌзЊвЦЕчзгЯрЕШЃЌдђЮіГіЭЕФжЪСП=![]() ЁС64g/mol=1.28gЁЃ
ЁС64g/mol=1.28gЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛьКЯШмвКжаЃЌИїРызгХЈЖШЕФДѓаЁЫГађе§ШЗЕФЪЧ
A. 10 mL 0.1 mol/LАБЫЎгы10 mL 0.1 mol/LбЮЫсЛьКЯЃКc(Cl)ЃОc(![]() )ЃОc(OH)ЃОc(H+)
)ЃОc(OH)ЃОc(H+)
B. 10 mL 0.1 mol/L NH4ClШмвКгы5 mL 0.2 mol/L NaOHШмвКЛьКЯЃКc(Na+)=c(Cl)ЃОc(OH)ЃОc(H+)
C. 10 mL 0.1 mol/L CH3COOHШмвКгы5 mL 0.2 mol/L NaOHШмвКЛьКЯЃКc(Na+)=c(CH3COO)ЃОc(OH)ЃОc(H+)
D. 10 mL 0.5 mol/L CH3COONaШмвКгы6 mL 1 mol/LбЮЫсЛьКЯЃКc(Cl)ЃОc(Na+)ЃОc(OH)ЃОc(H+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНќСНФъРДЮоШЫМнЪЛЦћГЕЕФДѓШШЪЙЕУМЄЙтРзДяГЩЮЊШЫУЧЙизЂЕФНЙЕуЃЌМЄЙтРзДяЕФКЫаФВПМўашвЊвЛжжЕЊЛЏТС(A1N)ЕМШШЬеДЩЦЌЁЃЯТЭМЪЧДгТСЭСПѓ(жївЊГЩЗжЮЊA12O3,ЛЙКЌгаЩйСПSiO2ЁЂ Fe2O3ЕШдгжЪ)жаЬсШЁA12O3ВЂЩњВњA1NЕФЙЄвеСїГЬЃК
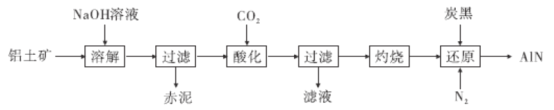
(1)ЁАШмНтЁБЪБЃЌвбжЊШмвКжаЕФЙшЫсФЦгыЦЋТСЫсФЦПЩЗЂЩњЗДгІЃК2Na2SiO3+2NaA1O2+2H2O=== Na2Al2Si2O8Ё§ +4NaOHЁЃГрФрЕФжївЊГЩЗжГ§СЫЩњГЩЕФNa2Al2Si2O8ЛЙга________(аДГіЛЏбЇЪН)ЃЌNa2Al2Si2O8гУбѕЛЏЮяЕФаЮЪНБэЪОЮЊ______________________________________________________ЁЃ
(2) ЁАЫсЛЏЁБЪБЭЈШыЙ§СПCO2гыNaA1O2ЗДгІЩњГЩNaHCO3 КЭСэвЛжжАзЩЋГСЕэЃЌЪдаДГіИУЗДгІЕФЛЏбЇЗНГЬЪН________________________________ЃЛЪЕбщЪвЙ§ТЫашгУЕНЕФВЃСЇвЧЦїгаЩеБЁЂ_____________________ЁЂВЃСЇАєЁЃ
(3)ЁАЛЙдЁБЪБЃЌЬПКкдкИпЮТЯТБЛбѕЛЏЮЊCO,ЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____________ЃЛ
(4)вбжЊЃКAlN+NaOH + H2O===NaA1O2+NH3 ЁќЁЃЯжШЁЕЊЛЏТСбљЦЗ5.0 g(МйЩшдгжЪжЛКЌгаЬПКк)МгЕН100 mL 1. 0 mol L-1ЕФNaOHШмвКжаЧЁКУЗДгІЭъЃЌдђИУбљЦЗжаA1NЕФжЪСПЗжЪ§ЮЊ ___________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПXЁЂYЁЂZЁЂWЮЊдзгађЪ§вРДЮдіДѓЕФЫФжжЖЬжмЦкжїзхдЊЫиЃЌXдзгЕФзюЭтВуЕчзгЪ§ЪЧЦфФкВуЕчзгЪ§ЕФ2БЖЃЌWЃЋгыY2ЃОпгаЯрЭЌЕФЕчзгВуНсЙЙЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.YгыЧтдЊЫиЫљаЮГЩЕФЛЏКЯЮяЗжзгжажЛКЌгаМЋадМќ
B.W2YЁЂW2Y2жавѕЁЂбєРызгИіЪ§БШОљЮЊ1ЁУ2
C.ZЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЕФЫсадБШXЕФЧП
D.НЋXY2ЭЈШыWЕЅжЪгыЫЎЗДгІКѓЕФШмвКжаЃЌЩњГЩЕФбЮжЛгавЛжж
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдЯТСаЭМЯёЕФУшЪіе§ШЗЕФЪЧ
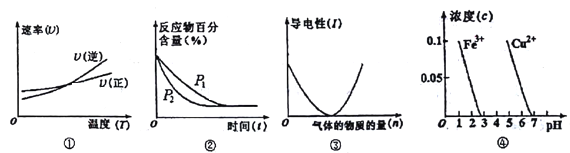
A. ИљОнЭМЂйХаЖЯЗДгІA2(g)+3B2(g) ![]() 2AB3(g)ЕФ ЁїH>0
2AB3(g)ЕФ ЁїH>0
B. ЭМЂкПЩБэЪОбЙЧП(P)ЖдЗДгІ2A(g)+2B(g) ![]() 3C(g)+D(s)ЕФгАЯь
3C(g)+D(s)ЕФгАЯь
C. ЭМЂлПЩБэЪОЯђДзЫсШмвКЭЈШыАБЦјЪБЃЌШмвКЕМЕчадЫцАБЦјСПЕФБфЛЏ
D. ИљОнЭМЂмЃЌГ§ШЅCuSO4ШмвКжаЕФFe3+ЃЌПЩМгШыCuOЕїНкpHжС3ЁЋ5
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЗЯЫЎжаКЌгаДѓСПЕФFeSO4ЁЂНЯЖрЕФCu2+КЭЩйСПЕФNa+ЁЃДгЙЄвЕЗЯЫЎжаЛиЪеСђЫсбЧЬњКЭН№ЪєЭЕФЙЄвеСїГЬШчЭМЫљЪОЁЃдђЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
A.ЪдМСXЮЊЬњЗл
B.ЪдМСYЮЊЯЁбЮЫсЃЌВйзїЂкЪЧЙ§ТЫ
C.ВйзїЂлЪЧЃКеєЗЂХЈЫѕЃЌРфШДНсОЇЃЌЙ§ТЫ
D.ПЩгУK3Fe(CN)6ШмвКРДМьбщЁАШмвК1ЁБжаЕФжївЊбєРызг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГрЭПѓЕФжївЊГЩЗжЪЧCu2OЃЌЛдЭПѓЕФжївЊГЩЗжЪЧCu2SЃЌНЋГрЭПѓгыЛдЭПѓЛьКЯМгШШЗЂЩњвдЯТЗДгІЃКCu2S+2Cu2O==6Cu+SO2ЁќЃЌЙигкИУЗДгІЕФЫЕЗЈжае§ШЗЕФЪЧ( )
A.ИУЗДгІЕФбѕЛЏМСжЛгаCu2O
B.Cu2SдкЗДгІжаМШЪЧбѕЛЏМСЃЌгжЪЧЛЙдМС
C.CuМШЪЧбѕЛЏВњЮягжЪЧЛЙдВњЮя
D.УПЩњГЩ19.2gCuЃЌЗДгІжазЊвЦ1.8molЕчзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧтЦјКЭЖўбѕЛЏЬМдквЛЖЈЬѕМўЯТПЩКЯГЩМзДМЃКCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ЁЃ
CH3OH(g)+H2O(g)ЁЃ
IЁЂдкКуЮТЬѕМўЯТЃЌЗжБ№НЋ2 molCO2КЭ6 mol H2ГфШывЛИіЙЬЖЈШнЛ§ЮЊ1LЕФУмБеШнЦїжаЃЌЫцзХЗДгІЕФНјааЃЌЦјЬхЛьКЯЮяжаn(H2)ЁЂn(CH3OH)гыЗДгІЪБМфtЕФЙиЯЕШчЯТБэ;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
nЃЈH2ЃЉ/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
nЃЈCH3OHЃЉ/mol | 0 | 0.50 | 0.80 | 0.90 | 0.99 | 1.00 | 1.00 |
(1)ЧА10minжаРћгУCO2БэЪОЕФЗДгІЫйТЪЮЊ____________ЁЃ
(2)ИУЮТЖШЯТЃЌДЫЗДгІЕФЦНКтГЃЪ§K=__________ЁЃ
(3)ИУЮТЖШЯТЃЌШєЯђЭЌШнЛ§ЕФСэвЛШнЦїжаЭЖШыЕФЃКCO2ЁЂH2ЁЂCH3OHЁЂH2OЕФХЈЖШЗжБ№ЮЊ2 molЁЄL-1ЁЂ2 molЁЄL-1ЁЂ1 molЁЄL-1ЁЂ1 molЁЄL-1ЃЌдђДЫЪБvе§_______vФц(ЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁА=ЁБ)ЁЃ
ЂђЁЂдкУмБеШнЦїжаГфШы1molCO2КЭ3 mol H2ЃЌВтЕУЛьКЯЦјЬхжаМзДМЕФЬхЛ§ЗжЪ§гыЮТЖШЕФЙиЯЕШчЭМAЫљЪОЃК
ЪдЛиД№ЯТСаЮЪЬтЃК
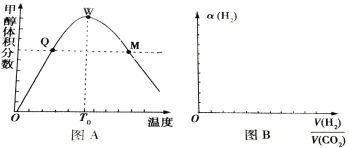
(1)ИУЗДгІЪЧ______(ЬюЁАЗХШШЁБЛђЁАЮќШШЁБ)ЗДгІЁЃ
(2)ЧтЦјдкQЕуЕФзЊЛЏТЪ_________(ЬюЁАДѓгкЁБЁЂЁАаЁгкЁБЛђЁАЕШгкЁБЃЌЯТЭЌ)ЧтЦјдкWЕуЕФзЊЛЏТЪЃЛ
(3)НтЪЭ0ЁЊT0ФкЃЌМзДМЕФЬхЛ§ЗжЪ§БфЛЏЧїЪЦЃК_______________ЁЃ
(4)ЭМBБэЪОЧтЦјзЊЛЏТЪІС(H2)гыЭЖСЯБШ![]() ЕФЙиЯЕЃЌЧыдкЭМBжаЛГіСНЬѕБфЛЏЧњЯпВЂБъГіЧњЯпЖдгІЕФЬѕМўЃЌСНЬѕЧњЯпЖдгІЕФЬѕМўЗжБ№ЮЊЃКвЛЬѕЧњЯпЖдгІЕФбЙЧПЪЧ1.01ЁС105PaЃЛСэвЛЬѕЧњЯпЖдгІЕФбЙЧПЪЧ3.03ЁС105Pa(ЦфЫќЬѕМўЯрЭЌ)________ЁЃ
ЕФЙиЯЕЃЌЧыдкЭМBжаЛГіСНЬѕБфЛЏЧњЯпВЂБъГіЧњЯпЖдгІЕФЬѕМўЃЌСНЬѕЧњЯпЖдгІЕФЬѕМўЗжБ№ЮЊЃКвЛЬѕЧњЯпЖдгІЕФбЙЧПЪЧ1.01ЁС105PaЃЛСэвЛЬѕЧњЯпЖдгІЕФбЙЧПЪЧ3.03ЁС105Pa(ЦфЫќЬѕМўЯрЭЌ)________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌЯТСагаЙиШмвКжаЮЂСЃЕФЮяжЪЕФСПХЈЖШЙиЯЕВЛе§ШЗЕФЪЧ
A.0.1 molЁЄLЃ1 CH3COONaШмвКгы0.1 molЁЄLЃ1 HClШмвКЕШЬхЛ§ЛьКЯЃКc(Na+)ЃНc(ClЃ)ЃОc(CH3COOЃ)ЃОc(OHЃ)
B.ЕШЬхЛ§ЁЂЕШЮяжЪЕФСПХЈЖШЕФNaXКЭШѕЫсHXЛьКЯКѓГЪЫсадЕФШмвКжаЃКc(XЃ)ЃОc(Na+)ЃОc(HX)ЃОc(H+)ЃОc(OHЃ)
C.0.1 molЁЄLЃ1 Na2CO3ШмвКгы0.1 molЁЄLЃ1 NaHCO3ШмвКЕШЬхЛ§ЛьКЯЃК3c(Na+)ЃН2c(![]() )ЃЋ2c(
)ЃЋ2c(![]() )ЃЋ2c(H2CO3)
)ЃЋ2c(H2CO3)
D.0.1 molЁЄLЃ1 Na2C2O4ШмвКгы0.1 molЁЄLЃ1 HClШмвКЕШЬхЛ§ЛьКЯ(H2C2O4ЮЊЖўдЊШѕЫс)ЃК2c(![]() )ЃЋc(
)ЃЋc(![]() )ЃЋc(OHЃ)ЃНc(Na+)ЃЋc(H+)
)ЃЋc(OHЃ)ЃНc(Na+)ЃЋc(H+)
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com