
【题目】近两年来无人驾驶汽车的大热使得激光雷达成为人们关注的焦点,激光雷达的核心部件需要一种氮化铝(A1N)导热陶瓷片。下图是从铝土矿(主要成分为A12O3,还含有少量SiO2、 Fe2O3等杂质)中提取A12O3并生产A1N的工艺流程:
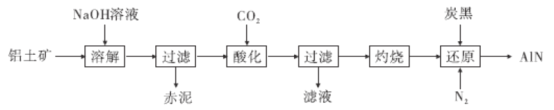
(1)“溶解”时,已知溶液中的硅酸钠与偏铝酸钠可发生反应:2Na2SiO3+2NaA1O2+2H2O=== Na2Al2Si2O8↓ +4NaOH。赤泥的主要成分除了生成的Na2Al2Si2O8还有________(写出化学式),Na2Al2Si2O8用氧化物的形式表示为______________________________________________________。
(2) “酸化”时通入过量CO2与NaA1O2反应生成NaHCO3 和另一种白色沉淀,试写出该反应的化学方程式________________________________;实验室过滤需用到的玻璃仪器有烧杯、_____________________、玻璃棒。
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_____________;
(4)已知:AlN+NaOH + H2O===NaA1O2+NH3 ↑。现取氮化铝样品5.0 g(假设杂质只含有炭黑)加到100 mL 1. 0 mol L-1的NaOH溶液中恰好反应完,则该样品中A1N的质量分数为 ___________________。
【答案】Fe2O3 Na2OAl2O32SiO2 NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3 漏斗 Al2O3+N2+3C![]() 2AlN+3CO ↑ 82%
2AlN+3CO ↑ 82%
【解析】
铝土矿(主要成分为A12O3,还含有少量SiO2、 Fe2O3等杂质),铝土矿中加入氢氧化钠溶液,SiO2和A12O3溶于氢氧化钠溶液,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaA1O2+2H2O=== Na2Al2Si2O8↓ +4NaOH,氧化铁不溶于氢氧化钠溶液,所以过滤得到的赤泥为Fe2O3、Na2Al2Si2O8,滤液主要为偏铝酸钠溶液,偏铝酸钠溶液中通入过量的二氧化碳酸化得到的沉淀为氢氧化铝,过滤得到的滤液主要为NaHCO3溶液,氢氧化铝灼烧得到氧化铝,氧化铝、碳黑、氮气在高温下生成氮化铝,同时碳被氧化为CO,据此解答此题。
(1)氧化铁与氢氧化钠不反应,则赤泥的主要成分为Fe2O3、Na2Al2Si2O8,Na2Al2Si2O8用氧化物的形式表示为Na2OAl2O32SiO2;
答案为:Fe2O3 ;Na2OAl2O32SiO2 ;
(2)“酸化”时通入过量CO2与NaA1O2反应生成Al(OH)3,反应的化学方程式为:NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3;实验室过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒;
答案为:NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3;漏斗;
(3)氧化铝、碳黑、氮气在高温下生成氮化铝,同时碳黑被氧化为CO,反应的化学方程式为:Al2O3+N2+3C![]() 2AlN+3CO ↑;
2AlN+3CO ↑;
答案为:Al2O3+N2+3C![]() 2AlN+3CO ↑;漏斗;
2AlN+3CO ↑;漏斗;
(4)加到100 mL 1. 0 mol L-1的NaOH溶液中恰好反应完,则n(NaOH)=0.1L1.0mol/L=0.1mol,根据反应AlN+NaOH + H2O===NaA1O2+NH3 ↑可知,n(AlN)= n(NaOH)=0.1mol,所以AlN的质量分数为:![]() ;
;
答案为:82%;


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】根据下列反应进行判断,下列各微粒氧化能力由强到弱的顺序正确的是( )
①ClO3-+5Cl-+6H+=3Cl2+3H2O ②2FeCl3+2KI=2FeCl2+2KCl+I2 ③2FeCl2+Cl2=2FeCl3
A.ClO3- >Cl2 >I2 >Fe3+B.Cl2> ClO3- >I2 >Fe3+
C.ClO3- >Cl2 >Fe3+ >I2D.ClO3- >Fe3+ >Cl2 >I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气法制取甲醇(CH3OH)的反应及其反应的焓变、平衡常数如下:
① CH4(g) +1/2O2(g)![]() CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
② CO(g) + 2H2(g) ![]() CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 平衡常数K3
2CH3OH(g) △H3 平衡常数K3
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________。
(2)依据盖斯定律求出反应③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
(3)下列关于化学反应中的能量及变化理解错误的是(填字母序号)______。
a.反应中活化能的作用是使反应物活化,从而启动反应或改变反应速率
b.化学键的断裂与形成一定伴随着电子的转移和能量变化
c.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定
d.氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化
e.200℃、101kPa时,1 mol H2和碘蒸气作用生成HI的反应,热化学方程式表示如下:H2(g)+I2(g) === 2HI(g) △H= -14.9 kJ·mol-1
f.燃烧热定义中“生成稳定的氧化物”,意味着这些氧化物不能再燃烧了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
A. 增加Ni的量可提高CO的转化率,Ni的转化率降低
B. 缩小容器容积,平衡右移,△H减小
C. 反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D. 当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】动手实践:某同学探究同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制的Na2S溶液中滴入新制氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向AlCl3溶液中滴加溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究___元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等。
仪器:①___,②___,③___,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)___
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) |
①的化学方程式___,
②的化学方程式___。
(4)实验结论:
失电子能力:___,得电子能力:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:NaHSO3溶液呈酸性。常温下,将0.1mol/L亚硫酸(忽略H2SO3的分解)与0.1mol/LNaOH溶液等体积混合,下列关于该混合溶液说法不正确的是( )
A.c(Na+)>c(HSO![]() )>c(H2SO3)>c(SO
)>c(H2SO3)>c(SO![]() )
)
B.c(Na+)=c(HSO![]() )+c(SO
)+c(SO![]() )+c(H2SO3)
)+c(H2SO3)
C.c(HSO![]() )+c(H2SO3)+c(SO
)+c(H2SO3)+c(SO![]() )=0.05mol/L
)=0.05mol/L
D.c(Na+)+c(H+)>c(HSO![]() )+c(SO
)+c(SO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容条件下发生下列反应:2X2O5 (g) ![]() 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s | 0 | 50 | 100 | 150 |
c(X2O5) mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (Ls)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以食盐为原料进行生产并综合利用的某些过程如图:
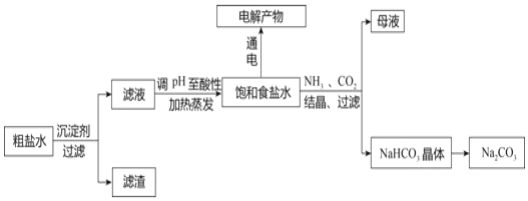
(1)除去粗盐中的微溶物质CaSO4通常用Na2CO3处理,请用平衡移动原理解释说明:____。
(2)人们习惯上把电解饱和食盐水的工业叫做氯碱工业。图1表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:
检验Y电极反应产物的方法是_____。电解NaCl溶液的离子方程式是____。
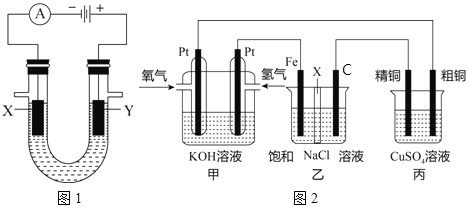
(3)某同学设计一个燃料电池(如图2所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
①通入氢气电极的反应式为____。
②石墨电极为_____(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,_____区(填“铁极”或“石墨极”)的溶液先变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____(填“增大”“减小”或“不变”)。
④若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为_____L;丙装置中阴极析出铜的质量为_____g。(铜的摩尔质量为64)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用实验器材(规格和数量不限,省略夹持装置),能够完成相应实验的有几项( )
实验器材 | 相应实验 | |
① | 量筒、温度计、烧杯、碎纸条、盖板 | 中和热的测定 |
② | 烧杯、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
③ | 量筒、玻璃捧、烧杯、100mL容量瓶 | 用浓盐酸配制100mL0.1molL-1的稀盐酸溶液 |
④ | 烧杯、酸式滴定管、碱式滴定管、锥形瓶 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
⑤ | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管、石棉网 | 分离甲醇和甘油的混合物 |
⑥ | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 从食盐水中得到NaCl晶体 |
A.2项B.3项C.4项D.5项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com