
【题目】在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
A. 增加Ni的量可提高CO的转化率,Ni的转化率降低
B. 缩小容器容积,平衡右移,△H减小
C. 反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D. 当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
科目:高中化学 来源: 题型:
【题目】(1)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式为_________。向反应后的溶液中通入少量CO2,反应的离子方程式为_______________。
(2)在100mLFeBr2溶液中通入标准状况下2.24LCl2,溶液中有1/4的Br- 被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为______________(结果保留两位小数)。
(3)三氟化氮(NF3)是一种无色无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式___________________,反应中生成0.2mol HNO3,转移的电子数目为__________。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl)>c(OH)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO)>c(OH)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2,X与W的最外层电子数相等。四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种氧化物能溶于烧碱溶液。四种元素的单质所形成的混合物有如下性质:
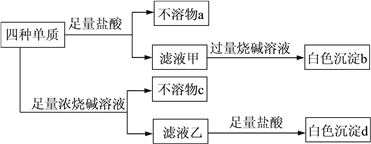
下列说法正确的是
A.原子半径:X>Y>Z>W
B.简单的气态氢化物的热稳定性:W>X
C.最高价氧化物对应水化物的碱性:Z>Y
D.X和W组成的化合物常作砂纸、砂轮的磨料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应![]() 达到平衡的标志是
达到平衡的标志是
A. ![]() 生成的速率和
生成的速率和![]() 分解的速率相等
分解的速率相等
B. ![]() 、
、![]() 、
、![]() 的浓度相等
的浓度相等
C. 单位时间内生成![]() ,同时生成
,同时生成![]()
D. ![]() 、
、![]() 、
、![]() 的分子数之比为1:3:2
的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验:
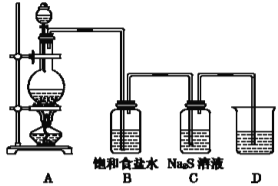
(1)装置A中制取的物质是___,化学方程式___。
(2)装置B的作用是___;C中的现象是___,离子方程式___,由此说明非金属性的强弱顺序是__。
(3)D中盛装的溶液是___,作用是___,离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近两年来无人驾驶汽车的大热使得激光雷达成为人们关注的焦点,激光雷达的核心部件需要一种氮化铝(A1N)导热陶瓷片。下图是从铝土矿(主要成分为A12O3,还含有少量SiO2、 Fe2O3等杂质)中提取A12O3并生产A1N的工艺流程:
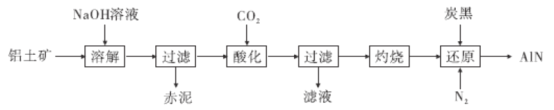
(1)“溶解”时,已知溶液中的硅酸钠与偏铝酸钠可发生反应:2Na2SiO3+2NaA1O2+2H2O=== Na2Al2Si2O8↓ +4NaOH。赤泥的主要成分除了生成的Na2Al2Si2O8还有________(写出化学式),Na2Al2Si2O8用氧化物的形式表示为______________________________________________________。
(2) “酸化”时通入过量CO2与NaA1O2反应生成NaHCO3 和另一种白色沉淀,试写出该反应的化学方程式________________________________;实验室过滤需用到的玻璃仪器有烧杯、_____________________、玻璃棒。
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_____________;
(4)已知:AlN+NaOH + H2O===NaA1O2+NH3 ↑。现取氮化铝样品5.0 g(假设杂质只含有炭黑)加到100 mL 1. 0 mol L-1的NaOH溶液中恰好反应完,则该样品中A1N的质量分数为 ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X原子的最外层电子数是其内层电子数的2倍,W+与Y2-具有相同的电子层结构。下列说法正确的是
A.Y与氢元素所形成的化合物分子中只含有极性键
B.W2Y、W2Y2中阴、阳离子个数比均为1∶2
C.Z的最高价氧化物对应的水化物的酸性比X的强
D.将XY2通入W单质与水反应后的溶液中,生成的盐只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和二氧化碳在一定条件下可合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
I、在恒温条件下,分别将2 molCO2和6 mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(CH3OH)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(CH3OH)/mol | 0 | 0.50 | 0.80 | 0.90 | 0.99 | 1.00 | 1.00 |
(1)前10min中利用CO2表示的反应速率为____________。
(2)该温度下,此反应的平衡常数K=__________。
(3)该温度下,若向同容积的另一容器中投入的:CO2、H2、CH3OH、H2O的浓度分别为2 mol·L-1、2 mol·L-1、1 mol·L-1、1 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
Ⅱ、在密闭容器中充入1molCO2和3 mol H2,测得混合气体中甲醇的体积分数与温度的关系如图A所示:
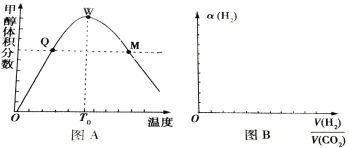
试回答下列问题:
(1)该反应是______(填“放热”或“吸热”)反应。
(2)氢气在Q点的转化率_________(填“大于”、“小于”或“等于”,下同)氢气在W点的转化率;
(3)解释0—T0内,甲醇的体积分数变化趋势:_______________。
(4)图B表示氢气转化率α(H2)与投料比![]() 的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com