
ЁОЬтФПЁПXЁЂYЁЂZЁЂWЪЧжабЇГЃМћЕФЫФжжЖЬжмЦкдЊЫиЃЌЦфдзгађЪ§вРДЮдіДѓЃЌЧвдзгКЫЭтзюЭтВуЕчзгЪ§ЖМВЛЩйгк2ЃЌXгыWЕФзюЭтВуЕчзгЪ§ЯрЕШЁЃЫФжждЊЫиЕФЕЅжЪОљФмдкбѕЦјжаШМЩеЃЌЩњГЩЫФжжЯрЖдЗжзгжЪСПЖМДѓгк26ЕФбѕЛЏЮяЃЌЦфжагаСНжжбѕЛЏЮяФмШмгкЯЁСђЫсЃЌШ§жжбѕЛЏЮяФмШмгкЩеМюШмвКЁЃЫФжждЊЫиЕФЕЅжЪЫљаЮГЩЕФЛьКЯЮягаШчЯТаджЪЃК
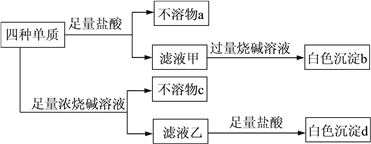
ЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.дзгАыОЖЃКX>Y>Z>W
B.МђЕЅЕФЦјЬЌЧтЛЏЮяЕФШШЮШЖЈадЃКW>X
C.зюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЕФМюадЃКZ>Y
D.XКЭWзщГЩЕФЛЏКЯЮяГЃзїЩАжНЁЂЩАТжЕФФЅСЯ
ЁОД№АИЁПD
ЁОНтЮіЁП
вРЬтвтжЊЃЌЫФжждЊЫиЕФЕЅжЪФмдкбѕЦјжаШМЩеЃЌЧвЩњГЩЕФбѕЛЏЮяЕФЯрЖдЗжзгжЪСПЖМДѓгк26ЃЌЦфжаШ§жжбѕЛЏЮяПЩгыЩеМюЗДгІЃЌСНжжбѕЛЏЮяОљПЩгыЯЁСђЫсЗДгІЃЌдђЫФжждЊЫижавЛЖЈгаAlЃЛТЫвКМзгыЙ§СПЧтбѕЛЏФЦШмвКЗДгІЩњГЩАзЩЋГСЕэbЃЌдђгавЛжждЊЫиЮЊMgЃЛТЫвКввгызуСПбЮЫсЗДгІФмЩњГЩАзЩЋГСЕэdЃЌдђгавЛжждЊЫиЮЊSiЃЛXгыWзюЭтВуЕчзгЪ§ЯрЕШЃЌдђXЮЊC(ЬМ)ЃЛЫљвдЃЌXЮЊC(ЬМ)ЃЌYЮЊMgЃЌZЮЊAlЃЌWЮЊSiЁЃ
AЯюЃЌдзгАыОЖr(Mg)>r(Al)>r(Si)>r(C)ЃЌДэЮѓЃЛ
BЯюЃЌЮШЖЈадCH4>SiH4ЃЌДэЮѓЃЛ
CЯюЃЌМюадMg(OH)2>Al(OH)3ЃЌДэЮѓЃЛ
DЯюЃЌЬМЛЏЙш(SiC)ЫзГЦН№ИеЩАЃЌЦфгВЖШЁЂШлЕуНЯИпЃЌГЃзїЩАжНЁЂЩАТжЕФФЅСЯЃЌе§ШЗЃЛ
Д№АИбЁDЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃК2CO(g)+O2(g)=2CO2(g) ЁїH=-566 kJЁЄmol-1
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) ЁїH=-452 kJЁЄmol-1
ИљОнвдЩЯШШЛЏбЇЗНГЬЪНХаЖЯЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. 1molCO ЭъШЋШМЩеЃЌЗХГіШШСПЮЊ283 J
B. Na2O2(s)+CO2(s)=Na2CO3(s)+ ![]() O2(g) ЁїH=-226 kJЁЄmol-l
O2(g) ЁїH=-226 kJЁЄmol-l
C. CO(g) гыNa2O2(s)ЗДгІЗХГі509kJ ШШСПЪБЃЌЕчзгзЊвЦЪ§ЮЊ1.204ЁС1024
D. CO ЕФШМЩеШШЮЊ566 kJЁЄmol-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУжЪСПЗжЪ§ЮЊ98%ЕФХЈСђЫс(ІбЃН1.84 gЁЄcm-3)ХфжЦ240 mL 1.84 molЁЄL-1ЯЁСђЫсЃЌЯТСаВйзїе§ШЗЕФЪЧ
A.НЋеєСѓЫЎЛКТ§зЂШыЪЂгавЛЖЈСПХЈСђЫсЕФЩеБжаЃЌВЂВЛЖЯНСАшжСРфШД
B.БиашЕФЖЈСПвЧЦїга50 mLСПЭВЁЂ250 mLШнСПЦПКЭЭаХЬЬьЦН
C.СПШЁХЈСђЫсЕФЬхЛ§ЮЊ25.0 mL
D.ЯШдкШнСПЦПжаМгШыЪЪСПЫЎЃЌНЋСПКУЕФХЈСђЫсзЂШыШнСПЦПЃЌМгЫЎЖЈШн
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигк10 mL 0.1 molЁЄLЃ1ЕФNH3ЁЄH2OШмвКЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ(ЁЁЁЁ)
A.25 ЁцЪБЃЌШєШмвКЕФpHЃН11ЃЌдђKb(NH3ЁЄH2O)ЃН1ЁС10Ѓ6molЁЄLЃ1
B.ЯђШмвКжаМгШыЩйСПCH3COONaЙЬЬхЃЌШмвКжаЕФ![]() жЕБфаЁ
жЕБфаЁ
C.ЯђШмвКжаМгШы10 mL 0.1 molЁЄLЃ1HClЃЌЫљЕУШмвКжаРызгХЈЖШДѓаЁЫГађЮЊc(NH4+)>c(ClЃ)>c(HЃЋ)>c(OHЃ)
D.ЯђШмвКжаМгШы5 mL 0.1 molЁЄLЃ1HClЃЌЫљЕУШмвКжаРызгЕФХЈЖШвЛЖЈЗћКЯЃКc(NH4+)ЃЋc(HЃЋ)ЃНc(ClЃ)ЃЋc(OHЃ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫЎУКЦјЗЈжЦШЁМзДМЃЈCH3OHЃЉЕФЗДгІМАЦфЗДгІЕФьЪБфЁЂЦНКтГЃЪ§ШчЯТЃК
Ђй CH4(g) +1/2O2(g)![]() CO(g) + 2H2(g) ЁїH1 =Ѓ35.4kJЁЄmolЃ1 ЦНКтГЃЪ§K1
CO(g) + 2H2(g) ЁїH1 =Ѓ35.4kJЁЄmolЃ1 ЦНКтГЃЪ§K1
Ђк CO(g) + 2H2(g) ![]() CH3OH (g) ЁїH2 =Ѓ90.1 kJЁЄmolЃ1 ЦНКтГЃЪ§K2
CH3OH (g) ЁїH2 =Ѓ90.1 kJЁЄmolЃ1 ЦНКтГЃЪ§K2
Ђл 2CH4(g) + O2(g) ![]() 2CH3OH(g) ЁїH3 ЦНКтГЃЪ§K3
2CH3OH(g) ЁїH3 ЦНКтГЃЪ§K3
ЃЈ1ЃЉдк25ЁцЁЂ101kPaЯТЃЌ1gвКЬЌМзДМШМЩеЩњГЩCO2КЭвКЬЌЫЎЪБЗХШШ22.68kJЁЃдђБэЪОМзДМШМЩеШШЕФШШЛЏбЇЗНГЬЪНЮЊ_________________________________ЁЃ
ЃЈ2ЃЉвРОнИЧЫЙЖЈТЩЧѓГіЗДгІЂл 2CH4(g) + O2(g) ![]() 2CH3OH(g) ЁїH3 =_____kJЁЄmolЃ1ЃЌЯрЭЌЮТЖШЯТK3=______ЃЈгУКЌK1ЁЂK2ДњЪ§ЪНБэЪОЃЉЁЃ
2CH3OH(g) ЁїH3 =_____kJЁЄmolЃ1ЃЌЯрЭЌЮТЖШЯТK3=______ЃЈгУКЌK1ЁЂK2ДњЪ§ЪНБэЪОЃЉЁЃ
ЃЈ3ЃЉЯТСаЙигкЛЏбЇЗДгІжаЕФФмСПМАБфЛЏРэНтДэЮѓЕФЪЧЃЈЬюзжФИађКХЃЉ______ЁЃ
aЃЎЗДгІжаЛюЛЏФмЕФзїгУЪЧЪЙЗДгІЮяЛюЛЏЃЌДгЖјЦєЖЏЗДгІЛђИФБфЗДгІЫйТЪ
bЃЎЛЏбЇМќЕФЖЯСбгыаЮГЩвЛЖЈАщЫцзХЕчзгЕФзЊвЦКЭФмСПБфЛЏ
cЃЎдквЛЖЈЬѕМўЯТЃЌФГвЛЛЏбЇЗДгІЪЧЮќШШЗДгІЛЙЪЧЗХШШЗДгІЃЌгЩЩњГЩЮягыЗДгІЮяЕФьЪжЕВюМДьЪБфЃЈЁїHЃЉОіЖЈ
dЃЎТШЛЏФЦОЇЬхШлЛЏЪБЃЌРызгМќБЛЦЦЛЕЃЌЮќЪеФмСПЃЌЗЂЩњЛЏбЇБфЛЏ
eЃЎ200ЁцЁЂ101kPaЪБЃЌ1 mol H2КЭЕтеєЦјзїгУЩњГЩHIЕФЗДгІЃЌШШЛЏбЇЗНГЬЪНБэЪОШчЯТЃКH2(g)ЃЋI2(g) === 2HI(g)ЁЁ ЁїH= -14.9 kJЁЄmolЃ1
fЃЎШМЩеШШЖЈвхжаЁАЩњГЩЮШЖЈЕФбѕЛЏЮяЁБЃЌвтЮЖзХетаЉбѕЛЏЮяВЛФмдйШМЩеСЫ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвдМзДМЮЊдСЯжЦШЁИпДПH2ЪЧживЊЕФбаОПЗНЯђЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉМзДМЫЎеєЦјжиећжЦЧтжївЊЗЂЩњвдЯТСНИіЗДгІЁЃ
жїЗДгІЃКCH3OH(g)ЃЋH2O(g)![]() CO2(g)ЃЋ3H2(g) ЁїHЃНЃЋ49kJЁЄmolЃ1
CO2(g)ЃЋ3H2(g) ЁїHЃНЃЋ49kJЁЄmolЃ1
ИБЗДгІЃКH2(g)ЃЋCO2(g) ![]() CO(g)ЃЋH2O(g) ЁїHЃНЃЋ41kJЁЄmolЃ1
CO(g)ЃЋH2O(g) ЁїHЃНЃЋ41kJЁЄmolЃ1
ЂйМзДМдкДпЛЏМСзїгУЯТСбНтПЩЕУЕНH2КЭCOЃЌЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊ__________________ЃЌМШФмМгПьЗДгІЫйТЪгжФмЬсИпCH3OHЦНКтзЊЛЏТЪЕФвЛжжДыЪЉЪЧ_________________________ЁЃ
ЂкЪЪЕБдіДѓЫЎДМБШ[n(H2O)ЃКn(CH3OH)]ЃЌгаРћгкМзДМЫЎеєЦјжиећжЦЧтЃЌРэгЩЪЧ___________ЁЃ
ЂлФГЮТЖШЯТЃЌНЋn(H2O)ЃКn(CH3OH)ЃН1ЃК1ЕФдСЯЦјГфШыКуШнУмБеШнЦїжаЃЌГѕЪМбЙЧПЮЊp1ЃЌЗДгІДяЕНЦНКтЪБзмбЙЧПЮЊp2ЃЌдђЦНКтЪБМзДМЕФзЊЛЏТЪЮЊ_________________ЃЈКіТдИБЗДгІЃЉЁЃ
ЃЈ2ЃЉЙЄвЕЩЯГЃгУCH4гыЫЎеєЦјдквЛЖЈЬѕМўЯТРДжЦШЁH2ЃЌЦфЗДгІдРэЮЊЃКCH4(g)ЃЋH2O(g)![]() CO(g)ЃЋ3H2(g) ЁїHЃНЃЋ203kJЁЄmolЃ1ЃЌдкШнЛ§ЮЊ3LЕФУмБеШнЦїжаЭЈШыЮяжЪЕФСПОљЮЊ3molЕФCH4КЭЫЎеєЦјЃЌдквЛЖЈЬѕМўЯТЗЂЩњЩЯЪіЗДгІЃЌВтЕУЦНКтЪБH2ЕФЬхЛ§ЗжЪ§гыЮТЖШМАбЙЧПЕФЙиЯЕШчЭМЫљЪОЁЃ
CO(g)ЃЋ3H2(g) ЁїHЃНЃЋ203kJЁЄmolЃ1ЃЌдкШнЛ§ЮЊ3LЕФУмБеШнЦїжаЭЈШыЮяжЪЕФСПОљЮЊ3molЕФCH4КЭЫЎеєЦјЃЌдквЛЖЈЬѕМўЯТЗЂЩњЩЯЪіЗДгІЃЌВтЕУЦНКтЪБH2ЕФЬхЛ§ЗжЪ§гыЮТЖШМАбЙЧПЕФЙиЯЕШчЭМЫљЪОЁЃ
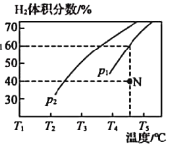
бЙЧПЮЊp1ЪБЃЌдкNЕуЃКvе§_______vФц(ЬюЁАДѓгкЁБЁАаЁгкЁБЛђЁАЕШгкЁБ)ЃЌNЕуЖдгІЮТЖШЯТИУЗДгІЕФЦНКтГЃЪ§KЃН________mol2ЁЄLЃ2ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛКуЮТЁЂКуШнУмБеШнЦїжаЗЂЩњЗДгІЃКNi(s)+4CO(g)![]() Ni(CO)4(g)ЃЌЁїH<0ЁЃРћгУИУЗДгІПЩвдНЋДжФјзЊЛЏЮЊДПЖШДя99.9ЃЅЕФИпДПФјЁЃЖдИУЗДгІЕФЫЕЗЈе§ШЗЕФЪЧ
Ni(CO)4(g)ЃЌЁїH<0ЁЃРћгУИУЗДгІПЩвдНЋДжФјзЊЛЏЮЊДПЖШДя99.9ЃЅЕФИпДПФјЁЃЖдИУЗДгІЕФЫЕЗЈе§ШЗЕФЪЧ
A. діМгNiЕФСППЩЬсИпCOЕФзЊЛЏТЪЃЌNiЕФзЊЛЏТЪНЕЕЭ
B. ЫѕаЁШнЦїШнЛ§ЃЌЦНКтгввЦЃЌЁїHМѕаЁ
C. ЗДгІДяЕНЦНКтКѓЃЌГфШыCOдйДЮДяЕНЦНКтЪБЃЌCOЕФЬхЛ§ЗжЪ§НЕЕЭ
D. ЕБ4v[Ni(CO)4]=v(CO)ЪБЛђШнЦїжаЛьКЯЦјЬхУмЖШВЛБфЪБЃЌЖМПЩЫЕУїЗДгІвбДяЛЏбЇЦНКтзДЬЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКNaHSO3ШмвКГЪЫсадЁЃГЃЮТЯТЃЌНЋ0.1mol/LбЧСђЫс(КіТдH2SO3ЕФЗжНт)гы0.1mol/LNaOHШмвКЕШЬхЛ§ЛьКЯЃЌЯТСаЙигкИУЛьКЯШмвКЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
A.c(Na+)>c(HSO![]() )>c(H2SO3)>c(SO
)>c(H2SO3)>c(SO![]() )
)
B.c(Na+)=c(HSO![]() )+c(SO
)+c(SO![]() )+c(H2SO3)
)+c(H2SO3)
C.c(HSO![]() )+c(H2SO3)+c(SO
)+c(H2SO3)+c(SO![]() )=0.05mol/L
)=0.05mol/L
D.c(Na+)+c(H+)>c(HSO![]() )+c(SO
)+c(SO![]() )+c(OH-)
)+c(OH-)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщгћжЦБИФІЖћбЮ[(NH4)2Fe(SO4)2ЁЄ6H2O]ВЂЬНОПЦфЗжНтВњЮяЁЃВщЕНШчЯТаХЯЂЃК
ФІЖћбЮПЩгЩFeSO4ШмвКгы(NH4)2SO4ШмвКЛьКЯжЦБИЃЛИУЮяжЪФмШмгкЫЎЁЂВЛШмгкввДМЃЌдкПеЦјжаФмж№НЅБЛбѕЛЏЃЛ100ЁцПЊЪМЗжНтЃЌЧвЗжНтВњЮяжаКЌгаЬњбѕЛЏЮяЁЂСђбѕЛЏЮяЁЂАБЦјКЭЫЎеєЦјЕШЁЃ
I.жЦБИФІЖћбЮ
(1)ЯђаТжЦЕФFeSO4ШмвКжаМгШы(NH4)2SO4ЙЬЬхЃЌМгШШЃЌЪЕбщЙ§ГЬжазюКУВЩгУ___________МгШШЗНЪНЁЃ
(2)еєЗЂХЈЫѕЁЂРфШДНсОЇЪЙФІЖћбЮНсОЇЮіГіЃЌОЇЬхЙ§ТЫКѓгУ_____________ЯДЕгЁЃ
(3)ИУаЁзщгУЕЮЖЈЗЈВтВњЦЗДПЖШЁЃЯжГЦШЁa gИУВњЦЗгкзЖаЮЦПжаЃЌМгеєСѓЫЎШмНтЃЌгУ0.1000mol/LЫсадKMnO4ШмвКЕЮЖЈЃЌЕНДяЕЮЖЈжеЕуЪБЃЌЯћКФKMnO4ШмвК20.00 mLЃЌдђИУВњЦЗЕФДПЖШЮЊ____________ЁЃ
II.ЬНОПФІЖћбЮЪмШШЗжНтЕФВњЮя
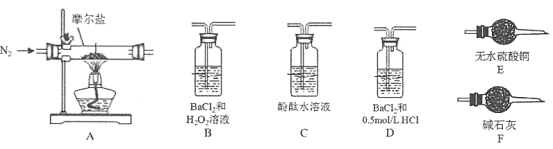
(4)бщжЄЗжНтВњЮяжаКЌгаАБЦјКЭЫЎеєЦјЃЌВЂЬНОПВаСєЙЬЬхГЩЗжЁЃ
ЂйЫљбЁгУзАжУЕФе§ШЗСЌНгЫГађЮЊ___________ЁЃ(ПЩбЁВПЗжвЧЦїЃЌЬюзАжУЕФзжФИађКХ)
ЂкAжаЙЬЬхЭъШЋЗжНтКѓБфЮЊКьзиЩЋЗлФЉЃЌЩшМЦЪЕбщжЄУїAжаВаСєЙЬЬхНіЮЊFe2O3ЃЌЖјВЛКЌFeOЛђFe3O4______________________ЁЃ
(5)ЬНОПЗжНтВњЮяжаЕФСђбѕЛЏЮяЃЌАДAЃDЃBЃFЕФЫГађСЌНгзАжУЃЌНјааЪЕбщЁЃ
ЂйDзАжУжаЪдМСЕФзїгУЪЧ____________________________________________ЁЃ
ЂкЪЕбщЙ§ГЬжаЃЌНіBжагаГСЕэЩњГЩЃЌЦфЫћЪЕбщжЄУїФІЖћбЮЪмШШЗжНтГ§ЩЯЪіВњЮяЭтЃЌЛЙгаN2ЩњГЩЁЃаДГіФІЖћбЮЪмШШЗжНтЕФЛЏбЇЗНГЬЪН__________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com