
【题目】关于10 mL 0.1 mol·L-1的NH3·H2O溶液,下列说法正确的是( )
A.25 ℃时,若溶液的pH=11,则Kb(NH3·H2O)=1×10-6mol·L-1
B.向溶液中加入少量CH3COONa固体,溶液中的![]() 值变小
值变小
C.向溶液中加入10 mL 0.1 mol·L-1HCl,所得溶液中离子浓度大小顺序为c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.向溶液中加入5 mL 0.1 mol·L-1HCl,所得溶液中离子的浓度一定符合:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
科目:高中化学 来源: 题型:
【题目】下列关于物质结构与性质的说法正确的是
A.标况下,22.4 L C2H2中所含的π键数和18 g冰中所含的氢键数均为2NA
B.由于氢键的作用NH3、H2O、HF的沸点反常,且高低顺序为HF>H2O>NH3
C.VSEPR模型就是分子的空间构型
D.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() 缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加人
缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加人![]() 溶液,整个过程中pH的变化如图所示,下列有关叙述正确的是( )
溶液,整个过程中pH的变化如图所示,下列有关叙述正确的是( )

A.曲线③④段有离子反应:![]()
B.可依据②处数据计算所溶解的![]()
C.③处表示氯气与氢氧化钠溶液恰好反应完全
D.①处![]() 约为
约为![]() 处
处![]() 的两倍
的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥少量MgSO4固体
A. ①②③⑤B. ③C. ③④⑥D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl)>c(OH)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO)>c(OH)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2,X与W的最外层电子数相等。四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种氧化物能溶于烧碱溶液。四种元素的单质所形成的混合物有如下性质:
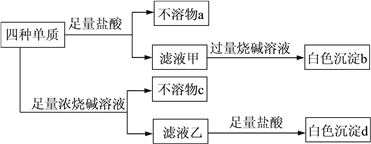
下列说法正确的是
A.原子半径:X>Y>Z>W
B.简单的气态氢化物的热稳定性:W>X
C.最高价氧化物对应水化物的碱性:Z>Y
D.X和W组成的化合物常作砂纸、砂轮的磨料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验:
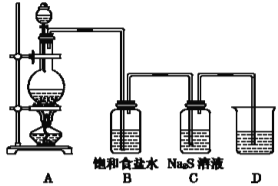
(1)装置A中制取的物质是___,化学方程式___。
(2)装置B的作用是___;C中的现象是___,离子方程式___,由此说明非金属性的强弱顺序是__。
(3)D中盛装的溶液是___,作用是___,离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。则下列说法不正确的是( )
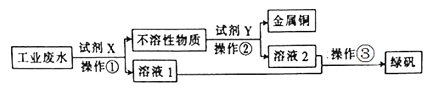
A.试剂X为铁粉
B.试剂Y为稀盐酸,操作②是过滤
C.操作③是:蒸发浓缩,冷却结晶,过滤
D.可用K3Fe(CN)6溶液来检验“溶液1”中的主要阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com