
【题目】水煤气法制取甲醇(CH3OH)的反应及其反应的焓变、平衡常数如下:
① CH4(g) +1/2O2(g)![]() CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
② CO(g) + 2H2(g) ![]() CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 平衡常数K3
2CH3OH(g) △H3 平衡常数K3
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________。
(2)依据盖斯定律求出反应③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
(3)下列关于化学反应中的能量及变化理解错误的是(填字母序号)______。
a.反应中活化能的作用是使反应物活化,从而启动反应或改变反应速率
b.化学键的断裂与形成一定伴随着电子的转移和能量变化
c.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定
d.氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化
e.200℃、101kPa时,1 mol H2和碘蒸气作用生成HI的反应,热化学方程式表示如下:H2(g)+I2(g) === 2HI(g) △H= -14.9 kJ·mol-1
f.燃烧热定义中“生成稳定的氧化物”,意味着这些氧化物不能再燃烧了
【答案】CH3OH(l)+3/2O2(g)=CO 2(g)+2H2O(l) ΔH=-725.76kJ·mol-1 -251 K12·K22 b d e
【解析】
(1)由1g液态甲醇燃烧放热22.68kJ,则1mol CH3OH燃烧放热22.68 kJ×32=725.76kJ,并在热化学方程式中标明物质的状态;
(2)根据盖斯定律求反应热;通过化学方程式加和求反应的平衡常数;
(3)a.活化能的作用在于使反应物活化,从而启动反应或改变反应速率;
b.成键释放能量,但不一定发生氧化还原反应;
c.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定;
d.氯化钠熔化只有离子键的断裂,没有新键的形成,不属于化学变化;
e.没有反应热数据,不能写出热化学方程式;
f. “生成稳定的氧化物” 指在燃烧的过程中不会再发生反应的氧化物,也就是完全燃烧。
(1) 由1g液态甲醇燃烧放热22.68kJ,则1mol CH3OH燃烧放热22.68 kJ×32=725.76kJ,则该燃烧反应的热化学方程式为CH3OH(l)+3/2O2(g)=CO 2(g)+2H2O(l) ΔH=-725.76kJ·mol-1,
因此,本题正确答案是:CH3OH(l)+3/2O2(g)=CO 2(g)+2H2O(l) ΔH=-725.76kJ·mol-1;
(2)已知:① CH4(g) +1/2O2(g)![]() CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1
CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1
② CO(g) + 2H2(g) ![]() CH3OH (g) △H2 =-90.1 kJ·mol-1
CH3OH (g) △H2 =-90.1 kJ·mol-1
根据盖斯定律,①×2+②×2得③ 2CH4(g) + O2(g) ![]() 2CH3OH(g)
2CH3OH(g)
故△H3 =(-35.4kJ·mol-1)×2+(-90.1 kJ·mol-1 )×2=-251kJ·mol-1,
相同温度下K3=![]() =
=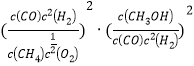 = K12·K22,
= K12·K22,
因此,本题正确答案是:-251 ;K12·K22 ;
(3)a.活化能的作用在于使反应物活化,从而启动反应或改变反应速率,故a正确;
b.成键释放能量,但不一定发生氧化还原反应,则化学键的形成一定伴随着能量变化,不一定存在电子的转移,故b错误;
c.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定,故c正确;
d.化学变化是旧键的断裂和新键的形成,氯化钠熔化只有离子键的断裂,没有新键的形成,不属于化学变化,故d错误;
e.没有反应热数据,不能写出热化学方程式,故e错误;
f. “生成稳定的氧化物” 指在燃烧的过程中不会再发生反应的氧化物,也就是完全燃烧,故f正确。
因此,本题答案选:b d e。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
A. AgCl不溶于水,不能转化为AgI
B. 在含有浓度均为0.001mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C. AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D. 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11mol·L-1
×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于甲烷的说法中错误的是( )
A. 甲烷化学性质比较稳定,不被任何氧化剂氧化
B. 甲烷分子具有正四面体结构
C. 甲烷分子中具有极性键
D. 甲烷分子中四个C﹣H键是完全相同的键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是研究铁钉腐蚀的装置图,下列说法不正确的是
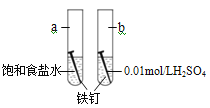
A. 铁钉在两处的腐蚀速率:a < b
B. a、b两处铁钉中碳均正极
C. a、b两处铁钉中的铁均失电子被氧化
D. a、b两处的正极反应式均为O2+4e-+4H+===2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl):试剂________,离子方程式___________。
(2)CO2(HCl):试剂________,离子方程式__________。
(3)![]() (CO
(CO![]() )试剂______________________,离子方程式______
)试剂______________________,离子方程式______
(4)C粉(Fe2O3):试剂____,离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)烟气(主要污染物SO2、NO、NO2)的大量排放造成严重的大气污染,国内较新研究成果是采用以尿素为还原剂的脱硫脱硝一体化技术。
(1)脱硫总反应:SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g),已知该反应能自发进行,则条件是____(填“高温”、“低温”或“任何温度”)。
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为______。


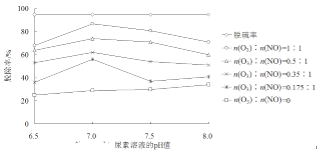
(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化见上图。
① n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是____。
② 臭氧量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因__。
(4)通过控制变量法研究脱除效率的影响因素得到数据如下图所示,下列说法正确的是____。
A. 烟气在尿素溶液中的反应:v(脱硫)<v(脱硝)
B. 尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C. 强酸性条件下不利于尿素对氮氧化物的脱除
D. pH=7的尿素溶液脱硫效果最佳

(5)尿素的制备:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
① 该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=__。

② 上图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①在NH4NO3中氮元素显+5价;
②4FeS2+11O2![]() 2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
③2Cu+O2![]() 2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
A.①B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)氯原子的结构示意图_____;工业上利用电解饱和食盐水来获得氯气,其化学方程式为_____。
(2)将氯气通入石灰乳中可制取漂白粉,化学方程式为_____。漂白粉溶于水后,和空气中的二氧化碳作用,所得的溶液可用于漂白这是利用生成的 HClO,而该溶液长时间放置又会失去漂白能力,所涉及的化学反应方程式为_____。
(3)向盛有 KI 溶液的试管中加入少许 CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4 层会逐渐变浅,最后变成无色。
完成下列填空:
(a)写出并配平 CCl4层由紫色变成无色的化学反应方程式,并用“单线桥”标出电子转移的方向和数目。_____________
_____+_____+_____→_____HIO3+_____该反应中,_____元素的化合价升高。
(b)把 KI 换成 KBr,则 CCl4层变为_____色,继续滴加氯水,CCl4 层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是_____。
(c)加碘盐中含碘量为 20mg~50mg/kg。制取加碘盐(含 KIO3 的食盐)1000kg,若 KI 与 Cl2 反应之 KIO3,至少需要消耗 Cl2_____mol(保留 2 位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,下列说法正确的是

A. 气球②中装的是O2
B. 气球①和③中分子数相等
C. 气球①和④中气体物质的量之比为4︰1
D. 气球③和④中气体密度之比为2︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com