
����Ŀ����������Դ�ı��⣬�̲��ŷḻ�Ļ�ѧԪ�أ����ȡ��塢��ȡ�
��1����ԭ�ӵĽṹʾ��ͼ_____����ҵ�����õ�ⱥ��ʳ��ˮ������������仯ѧ����ʽΪ_____��
��2��������ͨ��ʯ�����п���ȡƯ�ۣ���ѧ����ʽΪ_____��Ư������ˮ�Ϳ����еĶ�����̼���ã����õ���Һ������Ư�������������ɵ� HClO��������Һ��ʱ������ֻ�ʧȥƯ�����������漰�Ļ�ѧ��Ӧ����ʽΪ_____��
��3����ʢ�� KI ��Һ���Թ��м������� CCl4��μ���ˮ��CCl4������ɫ������������Թ��еμ���ˮ����CCl4 �����dz���������ɫ��
���������գ�
��a��д������ƽ CCl4������ɫ�����ɫ�Ļ�ѧ��Ӧ����ʽ�����������������������ת�Ƶķ������Ŀ��_____________
_____+_____+_____��_____HIO3+_____�÷�Ӧ�У�_____Ԫ�صĻ��ϼ����ߡ�
��b���� KI ���� KBr���� CCl4���Ϊ_____ɫ�������μ���ˮ��CCl4 �����ɫû�б仯��Cl2��HIO3��HBrO3��������ǿ������˳����_____��
��c���ӵ����к�����Ϊ 20mg��50mg/kg����ȡ�ӵ��Σ��� KIO3 ��ʳ�Σ�1000kg���� KI �� Cl2 ��Ӧ֮ KIO3��������Ҫ���� Cl2_____mol������ 2 λС������
���𰸡�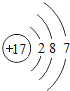 2NaCl+2H2O
2NaCl+2H2O![]() Cl2��+H2��+2NaOH 2Ca(
Cl2��+H2��+2NaOH 2Ca(
OH)
2+2Cl2��Ca(
ClO)2+CaCl2+2H2O Ca(
ClO)
2+CO2+H2O��CaCO3��+2HClO��2HClO![]() 2HCl+O2��
2HCl+O2�� ![]() 5Cl2 I2 6H2O 2 10HCl I ���� HBrO3��Cl2��HIO3 0.47
5Cl2 I2 6H2O 2 10HCl I ���� HBrO3��Cl2��HIO3 0.47
��������
��1����ԭ�ӵĺ��������Ϊ17�������Ϊ7�����ӣ�����ȷ��ԭ�ӽṹʾ��ͼΪ ����ҵ�����õ�ⱥ��ʳ��ˮ������������仯ѧ����ʽΪ2NaCl+2H2O
����ҵ�����õ�ⱥ��ʳ��ˮ������������仯ѧ����ʽΪ2NaCl+2H2O![]() Cl2��+H2��+2NaOH��
Cl2��+H2��+2NaOH��
�ʴ�Ϊ��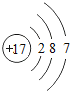 ��2NaCl+2H2O
��2NaCl+2H2O![]() Cl2��+H2��+2NaOH��
Cl2��+H2��+2NaOH��
��2���������������Ʒ�Ӧ�����Ȼ��ơ�������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽ��2Ca(
OH)
2+2Cl2��Ca(
ClO)2+CaCl2+2H2O�����������Ա�̼������Ca(ClO)2������е�CO2��Ӧ����HClO��CaCO3��������Ӧ�ķ���ʽΪCa(
ClO)
2+CO2+H2O��CaCO3��+2HClO��������Ư�ס�ɱ�����õĴ����ᣬ����Һ������Ư���������������ɵ�HClO�������ԣ�HClO�����ֽ⣬��ʧȥƯ���������ֽ�ķ���ʽΪ��2HClO![]() 2HCl+O2����
2HCl+O2����
�ʴ�Ϊ��2Ca(
OH)
2+2Cl2��Ca(ClO)2+CaCl2+2H2O��Ca(
ClO)2+CO2+H2O��CaCO3��+2HClO��2HClO![]() 2HCl+O2����
2HCl+O2����
��3��a����������ǿ�����ԣ���ʢ��KI��Һ���Թ��м�������CCl4��μ���ˮ��CCl4������ɫ��˵������I2���������Թ��еμ���ˮ����CCl4�����dz���������ɫ��˵��I2����һ������������HIO3��ͬʱ��������ԭΪHCl����Ӧ�ķ���ʽΪ��5Cl2+I2+6H2O��2HIO3+10HCl����Ӧ��IԪ�صĻ��ϼ����ߣ��������������������ת�Ƶķ������ĿΪ![]() ��
��
�ʴ�Ϊ��![]() ��5Cl2��I2��6H2O��2��10HCl��I��
��5Cl2��I2��6H2O��2��10HCl��I��
b��KI����KBrʱ���õ������嵥�ʣ�������CCl4�гʺ���ɫ�������μ���ˮʱ����ɫ���䣬��֪��ˮ���ܽ��嵥��������HBrO3����������ǿ��˳��Ϊ��HBrO3��Cl2��HIO3��
�ʴ�Ϊ�����أ�HBrO3��Cl2��HIO3��
c.1000kg�ӵ�ʳ���к���20g��KI+3Cl2+3H2O��KIO3+6HCl������KIO3��I��KI��3Cl2��֪������Ҫ����Cl2�����ʵ�����![]() ��3��0.47mol��
��3��0.47mol��
�ʴ�Ϊ��0.47��


 ����5��2���ϵ�д�
����5��2���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʻ�Ϊͬ���칹�����
A. ���Ͱ���B. 뭺��
C. ˮ��˫��ˮD. ��������춡��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮú������ȡ�״���CH3OH���ķ�Ӧ���䷴Ӧ���ʱ䡢ƽ�ⳣ�����£�
�� CH4(g) +1/2O2(g)![]() CO(g) + 2H2(g) ��H1 =��35.4kJ��mol��1 ƽ�ⳣ��K1
CO(g) + 2H2(g) ��H1 =��35.4kJ��mol��1 ƽ�ⳣ��K1
�� CO(g) + 2H2(g) ![]() CH3OH (g) ��H2 =��90.1 kJ��mol��1 ƽ�ⳣ��K2
CH3OH (g) ��H2 =��90.1 kJ��mol��1 ƽ�ⳣ��K2
�� 2CH4(g) + O2(g) ![]() 2CH3OH(g) ��H3 ƽ�ⳣ��K3
2CH3OH(g) ��H3 ƽ�ⳣ��K3
��1����25�桢101kPa�£�1gҺ̬�״�ȼ������CO2��Һ̬ˮʱ����22.68kJ�����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ_________________________________��
��2�����ݸ�˹���������Ӧ�� 2CH4(g) + O2(g) ![]() 2CH3OH(g) ��H3 =_____kJ��mol��1����ͬ�¶���K3=______���ú�K1��K2����ʽ��ʾ����
2CH3OH(g) ��H3 =_____kJ��mol��1����ͬ�¶���K3=______���ú�K1��K2����ʽ��ʾ����
��3�����й��ڻ�ѧ��Ӧ�е��������仯���������ǣ�����ĸ��ţ�______��
a����Ӧ�л�ܵ�������ʹ��Ӧ�����Ӷ�������Ӧ��ı䷴Ӧ����
b����ѧ���Ķ������γ�һ�������ŵ��ӵ�ת�ƺ������仯
c����һ�������£�ijһ��ѧ��Ӧ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ�����������뷴Ӧ�����ֵ��ʱ䣨��H������
d���Ȼ��ƾ����ۻ�ʱ�����Ӽ����ƻ�������������������ѧ�仯
e��200�桢101kPaʱ��1 mol H2�͵�������������HI�ķ�Ӧ���Ȼ�ѧ����ʽ��ʾ���£�H2(g)��I2(g) === 2HI(g)�� ��H= -14.9 kJ��mol��1
f��ȼ���ȶ����С������ȶ������������ζ����Щ�����ﲻ����ȼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������������б���ʴΪ�غ�ɫ����FeCl3����������������dz��ɫ��FeCl2��Һ����Cl2��Cl����H���У����������Ե���____________��������������ǿ����____________��
��2�������ڲ�ͬ�ķ�Ӧ�п��Էֱ���ֳ����ԡ������Ժͻ�ԭ�ԡ�����������������Ӧ����д��������������Ӧ�зֱ���������ã�
��Zn��2HCl===ZnCl2��H2��____________________��
��NaOH��HCl===NaCl��H2O__________________��
��2HCl![]() H2����Cl2��________________________��
H2����Cl2��________________________��
��3�������������б���ʴ���غ�ɫ����FeCl3����������������dz��ɫ��Һ(FeCl2)����Ũ�����еμ�KMnO4��Һ����������ɫ����(Cl2)����Cl2��H����![]() �У�__________________��������ǿ��
�У�__________________��������ǿ��
��4�������������������Һ���Է������з�Ӧ��2KMnO4��16HBr===5Br2��2MnBr2��2KBr��8H2O�����л�ԭ����________________��������15.8 g���������������Ļ�ԭ����������______________g��HBr��������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���������ʵ��װ�ã�����Ũ���������ǵķ�Ӧʵ�顣

��1��ʵ�鿪ʼʱ��������ƿ�м���15g���ǣ������뼸��ˮʹ������ȫʪ��Ȼ��ӷ�Һ©���м���15mLŨ���ᣬˮ��������_________��
��2��ʵ������ƿ�ں�ɫ�����������͵�ԭ����________���û�ѧ����ʽ��ʾ����
��3��Ϊ�˼���ʵ���в�����CO2���������ӿ�a֮���ʵ�����������_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ɱ���ܱ�������ʢ��������N2��H2�Ļ�����壬��һ�������·�����Ӧ��N2��g��+3 H2 ��g��![]() 2NH3��g��,��ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ�����������ΪV L,����NH3�������0.1 V L������˵����ȷ����
2NH3��g��,��ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ�����������ΪV L,����NH3�������0.1 V L������˵����ȷ����
A. ԭ�����������Ϊ1.2V L B. ��Ӧ��ƽ��ʱN2���ĵ�0.2 V L
C. ԭ�����������Ϊ1.1VL D. ��Ӧ��ƽ��ʱH2���ĵ�0.5 V L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��������ԭ�����һ�����Ϳɳ��أ���ͬ��̬�ĺ���������Ϊ���������Ļ������ʣ��ֱ��ڸ��Ե����Ե��Һ�����С���ṹԭ����ͼ��ʾ���õ�طŵ�ʱ���Ҳ��еĵ缫��ӦΪ��V2+-e-=V3+������˵����ȷ����( )

A���ŵ�ʱ���Ҳ۷�����ԭ��Ӧ
B���ŵ�ʱ����۵ĵ缫��Ӧʽ��VO2++2H++e-=VO2++H2O
C�����ʱ��ÿת��1mol���ӣ�n(H+)�ı仯��Ϊ1mol
D�����ʱ���������ҺpH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�������NOx��SO2����������Ҫ�ɷ֡�
��NOx��Ҫ��Դ������β����
��֪��N2��g����O2��g��![]() 2NO��g�� ��H����180.50 kJ��mol��1
2NO��g�� ��H����180.50 kJ��mol��1
2CO��g����O2��g��![]() 2 CO2��g�� ��H����566.00kJ��mol��1
2 CO2��g�� ��H����566.00kJ��mol��1
��1��Ϊ�˼��������Ⱦ���������������β�������ܿڲ��ô�����NO��COת��������Ⱦ����������ѭ����д���÷�Ӧ���Ȼ�ѧ����ʽ_________________��
��2��T��ʱ���������ʵ�����NO��CO�����ݻ�Ϊ2L���ܱ������У������¶Ⱥ�������䣬��Ӧ���̣�0��15min����NO�����ʵ�����ʱ��仯�Ĺ�ϵ����ͼ��ʾ��


��T��ʱ�û�ѧ��Ӧ��ƽ�ⳣ��K��_______________��ƽ��ʱ�������¶Ȳ��䣬���������г���CO��N2��0.8mol��ƽ�⽫_______�ƶ���������������������������������
��ͼ��a��b�ֱ��ʾ��һ���¶��£�ʹ��������ͬ���������ͬ�Ĵ���ʱ���ﵽƽ�������n(NO)�ı仯���ߣ����б�ʾ����������ϴ��������__________������a������b������
��15minʱ�����ı���練Ӧ����������n(NO)������ͼ��ʾ�ı仯����ı������������_______��
����SO2��Ҫ��Դ��ú��ȼ�ա�ȼú��������������Ǽ��ٴ����к�������Ⱦ�Ĺؼ���
��3���ô�����Һ����SO2�ɽ���ת��ΪHSO3�����÷�Ӧ�����ӷ���ʽ��___________________��
��4����ͼ���װ�ÿɽ������е�NO��SO2�ֱ�ת��ΪNH4+��SO42��������A�Ļ�ѧʽΪ_____________�������ĵ缫��Ӧʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ�ǣ� ��
A. ��ˮ��ͨ��������Cl2+H2O2H++Cl��+ClO��
B. ����������Ũ���ᷴӦ��MnO2+4HCl��Ũ��![]() Mn2++2Cl2��+2H2O
Mn2++2Cl2��+2H2O
C. ̼��������Һ�ӹ�������ʯ��ˮ��2HCO3��+Ca2++2OH���TCaCO3��+2H2O+CO32��
D. ������������ͭ��Һ��Ӧ��2Na+2H2O+Cu2+�T2Na++Cu��OH��2��+H2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com