
【题目】根据下列反应进行判断,下列各微粒氧化能力由强到弱的顺序正确的是( )
①ClO3-+5Cl-+6H+=3Cl2+3H2O ②2FeCl3+2KI=2FeCl2+2KCl+I2 ③2FeCl2+Cl2=2FeCl3
A.ClO3- >Cl2 >I2 >Fe3+B.Cl2> ClO3- >I2 >Fe3+
C.ClO3- >Cl2 >Fe3+ >I2D.ClO3- >Fe3+ >Cl2 >I2
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态D.上述反应的逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示同温度下,pH = 1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且b点溶液的导电性比a点强
B. 图2表示0.1000 mol/L CH3COOH溶液滴定20.00mL0.1000mol/LNaOH溶液所得到的滴定曲线
C. 图3表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式为_________。向反应后的溶液中通入少量CO2,反应的离子方程式为_______________。
(2)在100mLFeBr2溶液中通入标准状况下2.24LCl2,溶液中有1/4的Br- 被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为______________(结果保留两位小数)。
(3)三氟化氮(NF3)是一种无色无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式___________________,反应中生成0.2mol HNO3,转移的电子数目为__________。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像,其中说法正确的是

A. 由图Ⅰ知,反应在 T1、T3 处达到平衡
B. 由图Ⅰ知,该反应的△H<0
C. 由图Ⅱ知,t3时采取降低反应温度的措施
D. 由图Ⅱ知,反应在 t6时,NH3 体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() 缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加人
缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加人![]() 溶液,整个过程中pH的变化如图所示,下列有关叙述正确的是( )
溶液,整个过程中pH的变化如图所示,下列有关叙述正确的是( )

A.曲线③④段有离子反应:![]()
B.可依据②处数据计算所溶解的![]()
C.③处表示氯气与氢氧化钠溶液恰好反应完全
D.①处![]() 约为
约为![]() 处
处![]() 的两倍
的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 L 3.0 mol·L-1的NH4NO3溶液中含有的![]() 的数目为0.3NA
的数目为0.3NA
B.1.0 L 0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
C.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.1NA
D.1 L 0.1 mol·L-1的Na2CO3溶液中所含氧原子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl)>c(OH)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO)>c(OH)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近两年来无人驾驶汽车的大热使得激光雷达成为人们关注的焦点,激光雷达的核心部件需要一种氮化铝(A1N)导热陶瓷片。下图是从铝土矿(主要成分为A12O3,还含有少量SiO2、 Fe2O3等杂质)中提取A12O3并生产A1N的工艺流程:
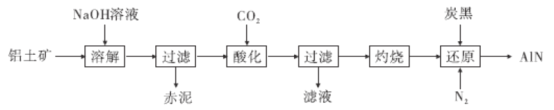
(1)“溶解”时,已知溶液中的硅酸钠与偏铝酸钠可发生反应:2Na2SiO3+2NaA1O2+2H2O=== Na2Al2Si2O8↓ +4NaOH。赤泥的主要成分除了生成的Na2Al2Si2O8还有________(写出化学式),Na2Al2Si2O8用氧化物的形式表示为______________________________________________________。
(2) “酸化”时通入过量CO2与NaA1O2反应生成NaHCO3 和另一种白色沉淀,试写出该反应的化学方程式________________________________;实验室过滤需用到的玻璃仪器有烧杯、_____________________、玻璃棒。
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_____________;
(4)已知:AlN+NaOH + H2O===NaA1O2+NH3 ↑。现取氮化铝样品5.0 g(假设杂质只含有炭黑)加到100 mL 1. 0 mol L-1的NaOH溶液中恰好反应完,则该样品中A1N的质量分数为 ___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com