
下列离子方程式书写正确的是( )。
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
B.将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+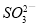
C.用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓
D.向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
科目:高中化学 来源:2015届湖北省高三上学期起点考试化学试卷(解析版) 题型:选择题
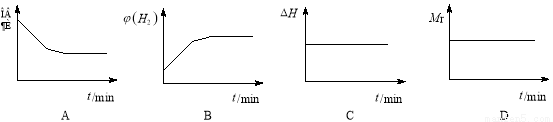
在密闭容器中进行反应:X(g)+3Y(g) 2Z(g),有关下列图像的说法正确的是
2Z(g),有关下列图像的说法正确的是

A.依据图a可判断正反应为吸热反应
B.在图b中,虚线可表示压强增大
C.若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源:2015届湖北省新高三起点调研测试化学试卷(解析版) 题型:选择题
下列实验方案或操作合理的是
A.用过滤法可以除去Fe(OH)3胶体中的Cl-
B.铜与浓硫酸反应时,可用蘸有浓溴水的棉花放在导管口吸收逸出的气体
C.实验室需用某浓度的NaOH溶液450 mL,则配制时应选用容积为450 mL的容量瓶
D.通过加人过量的FeS使工业废水中的Cu2+转化成硫化物沉淀而除去
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高三上学期起点考试化学试卷(解析版) 题型:填空题
碳及其化合物有广泛应用。
(1)工业冶炼铝,以石墨为阳极。阳极反应式为 ,可能发生副反应有 。
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为 。
(3)向75 mL 4 mol?L-1KOH溶液中缓慢通入4480 mL CO2气体(标准状况)恰好完全被吸收。①写出该反应的离子方程式: 。(只用一个离子方程式表示)
②该吸收溶液中离子浓度大小排序为 。
(4)已知:① 2H2(g)+O2(g)=2H2O(l) △H1=—571.6kJ?mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = —566.0kJ?mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 = —90.8kJ?mol-1
CH3OH(g) △H3 = —90.8kJ?mol-1
计算甲醇蒸气的燃烧热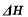 = 。
= 。
(5)某温度下,发生可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) 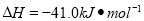
①向某容器中充入1.0 molH2和1.0 molCO2(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
| 0 | 5 min | 10 min | 15 min | 20 min | 25 min |
I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
II(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验I,实验II可能改变的条件可能是 ,该温度下,平衡常数= 。
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应。
下列图像正确且说明可逆反应达到平衡状态的是 。(填序号)
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高三上学期起点考试化学试卷(解析版) 题型:选择题
下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:
c(Na+)>c(Cl-)> c(CH3COOH)
B.等物质的量浓度等体积的硫化钠溶液与硫酸氢钾溶液混合
C(Na+)> C(K+)> C(SO42-)> C(HS-)> C(OH-)>C(H+)
C.pH <7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2 c(A2-)==c(OH-) +c (H2A)
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高三上学期起点考试化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关。下列说法不正确的是( )
A.光导纤维导电能力很强,是一种很好的通讯材料
B.纯碱不仅有较强的去油污能力,还可以用于中和发酵面团中的酸性物质
C.煤的气化和液化都属于化学变化
D.钛被誉为“太空金属”,室温下不与水、稀硫酸、稀硝酸反应,却溶于氢氟酸,可能是因为氟离子易与钛离子形成可溶性难电离物质
查看答案和解析>>
科目:高中化学 来源:2015届湖北省孝感市七校联考高二下学期期中考试化学试卷(解析版) 题型:选择题
某元素的原子最外电子层排布是5s25p1,该元素或其化合物不可能具有的性质是 ( )
A.该元素单质是导体
B.该元素单质在一定条件下能与盐酸反应
C.该元素的最高化合价呈+5价
D.该元素的氧化物的水合物显碱性
查看答案和解析>>
科目:高中化学 来源:2015届浙江省协作体高考摸底测试理科综合化学试卷(解析版) 题型:实验题
(14分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。
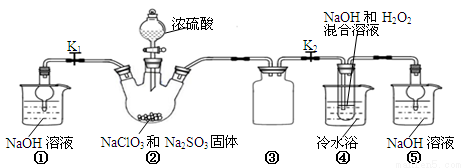
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水, 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol?L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6) 样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期初联考化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.CH3COOH 溶液加水稀释后,溶液中 的值增大
的值增大
D. 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com