
| 配 料 | 氯化钠、碘酸钾、抗结剂 |
| 净含量 | 500g |
| 碘含量 | 20~30mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| ||
| ||
 ,
, ;
;
| ||
0.01L× 2.0×10-3mol?L-1×
| ||
| wg |
| 1270 |
| 3w |
| 1270 |
| 3w |


科目:高中化学 来源: 题型:
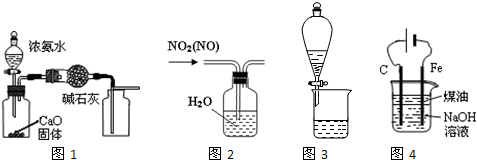
| A、用图1装置制取并收集干燥纯净的NH3 |
| B、用图2所示装置可除去NO2中的NO |
| C、用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 |
| D、用图4装置制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,23g NO2含有NA个氧原子 |
| B、25℃、101.3kPa时,11.2L H2中含有的原子数为NA |
| C、标准状况下,22.4L H2O中含有的分子数为NA |
| D、2.3g的金属钠变为钠离子时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,32g O2含有的原子数为2NA |
| B、100mL 1mol?L-1氨水中,含有OH-离子数是0.1 NA |
| C、100mL 2 mol?L-1碳酸钠溶液中,CO32-离子数为0.2NA |
| D、标准状况下,22.4LCl2通入足量NaOH溶液,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、只有① |
| C、只有④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.
白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.查看答案和解析>>
科目:高中化学 来源: 题型:
 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫--酸雨 |
| B、二氧化碳--温室效应 |
| C、水体富营养化--水华 |
| D、二氧化硅--白色污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com