
【题目】200mL 1molL—1的氯化铝溶液中加入一定体积的2molL—1的NaOH溶液,最终产生7.8g沉淀,则加入的NaOH溶液的体积可能为
①350mL ②90mL ③150mL ④200mL
A. 只有① B. ①③ C. ②④ D. ②③
【答案】B
【解析】
AlCl3和NaOH反应,当NaOH不足时生成Al(OH)3,当碱过量时,则生成NaAlO2.AlCl3的物质的量为0.2 mol,完全生成Al(OH)3沉淀时,沉淀质量应为15.6 g,大于实际沉淀质量为7.8 g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,据此计算.
0.2mol×78g/mol = 15.6 g>7.8 g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,n[Al(OH)3]=![]() = 0.1 mol,
= 0.1 mol,
①若碱不足,由Al3++3OH═Al(OH)3↓可知,NaOH的物质的量为0.1 mol×3=0.3 mol,故加入NaOH溶液的体积为![]() = 0.15 L = 150 mL,
= 0.15 L = 150 mL,
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH═Al(OH)3↓
1 3 1
0.1mol0.3mol0.1mol
故转化AlO2的Al3+的物质的量=0.2 mol0.1 mol=0.1 mol,
Al3++4OH═AlO2+2H2O
1 4
0.1mol 0.4mol
则消耗的碱的物质的量为0.3 mol+0.4 mol=0.7 mol,加入NaOH溶液的体积为![]() = 0.35 L = 350 mL,故B项正确,
= 0.35 L = 350 mL,故B项正确,
答案选B。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )
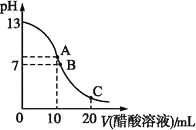
A. 在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B. 在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C. 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3—、CO32—、SO42—中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是_________________,一定存在的阳离子是__________________________。
(2)写出实验③图像中沉淀开始减少至完全消失阶段发生反应的离子反应方程式:__________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______________________,所得沉淀的最大质量是_____________________g。
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L1,试判断原废水中NO3是否存在?_______(填“存在”“不存在”或“不确定”)。 若存在,c(NO3)=___________mol·L1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。
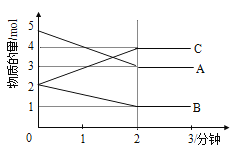
(1)该反应的的化学方程式为_____________________________。
(2)反应开始至2分钟时,B的平均反应速率为_________。
(3)能说明该反应已达到平衡状态的是___________。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(4)由图求得平衡时A的转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图示装置制取干燥的氨气:
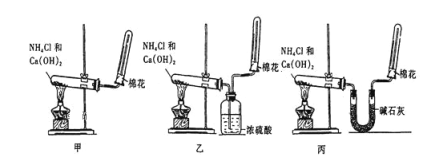
(1)实验室制备氨气化学方程式是_______________________________。
(2)工业制备氨气的化学方程式是_____________________________________________。
(3)若想制得干燥的氨气,应选择装置_______(填“甲”“乙”或“丙”),不能用乙装置干燥氨气的原因_______________________________(用化学方程式表示)。
(4)检验试管C中氨气收集满的方法是______________________。
(5)试管口放置棉花的作用是_________________________________________。
(6)某同学设计了如图装置收集氨气,下列说法不正确的是________(填字母)。
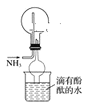
A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2![]() 2NH3,反应过程如下图所示,下列说法正确的是
2NH3,反应过程如下图所示,下列说法正确的是
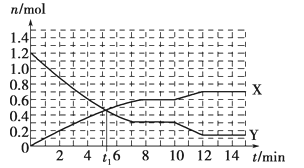
A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率为v(N2)=0.25mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,28g由C2H4和C3H6组成的混合气体所含原子数为6NA
B. 由0.1mol双氧水参加反应生成氧气,转移的电子总数一定为0.2NA
C. 0.lmol/L(NH4)2SO4溶液与0.2mol/LNH4Cl溶液中的NH4+数目相同
D. 2.4gT218O所含中子数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校购买的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为1.84mol/L
B. 1mol Zn与足量的该硫酸反应产生2gH2
C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com