
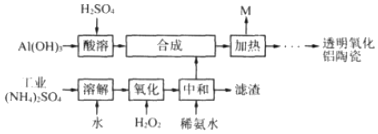
分析 Al(OH)3、H2SO4发生反应为2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O;
工业(NH4)2SO4(含FeSO4)溶于水,然后向溶液中加入双氧水,双氧水具有氧化性、硫酸亚铁具有还原性,二者发生氧化还原反应生成铁离子和水,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,将得到的溶液中加入氨水,调节溶液的pH,使铁离子转化为Fe(OH)3沉淀,然后过滤得到滤渣;将滤液加入硫酸铝溶液中,通过分离得到固体NH4Al(SO4)2•12H2O,加热固体NH4Al(SO4)2•12H2O,该物质分解生成M和含铝物质,
(1)双氧水和亚铁离子发生氧化还原反应生成铁离子和水;
(2)中和液中的杂质离子是铁离子,铁离子用KSCN溶液检验;
(3)工业上是电解熔融氧化铝制备金属铝;
解答 解:Al(OH)3、H2SO4发生反应为2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O;
工业(NH4)2SO4(含FeSO4)溶于水,然后向溶液中加入双氧水,双氧水具有氧化性、硫酸亚铁具有还原性,二者发生氧化还原反应生成铁离子和水,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,将得到的溶液中加入氨水,调节溶液的pH,使铁离子转化为Fe(OH)3沉淀,然后过滤得到滤渣;将滤液加入硫酸铝溶液中,通过分离得到固体NH4Al(SO4)2•12H2O,加热固体NH4Al(SO4)2•12H2O,该物质分解生成M和含铝物质,
(1)双氧水和亚铁离子发生氧化还原反应生成铁离子和水,过氧化氢作用是氧化亚铁离子生成铁离子,便于除去,离子反应方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:氧化亚铁离子为铁离子,2Fe2++H2O2+2H+═2Fe3++2H2O;
(2)中和液中的杂质离子是铁离子,铁离子用KSCN溶液检验,其检验方法为取少量中和后的溶液,滴加KSCN溶液,若溶液不变红,则已完全除去;若溶液变红,则未除尽,
故答案为:取少量中和后的溶液,滴加KSCN溶液,若溶液不变红,则已完全除去;若溶液变红,则未除尽;
(3)工业制备金属铝的化学方程式为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,
故答案为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;
点评 本题考查物质制备实验方案评价,为高频考点,侧重考查学生分析、推断、计算能力,明确流程图中发生的反应及基本操作是解本题关键,题目难度中等.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 含1个双键的环状有机物 | B. | 含2个双键的直链有机物 | ||
| C. | 只含有1个双键的直链有机物 | D. | 含一个三键的直链有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 30.32 | 25.34 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (不考虑立体异构)
(不考虑立体异构) +CH3CHO$\stackrel{稀碱}{→}$
+CH3CHO$\stackrel{稀碱}{→}$ $\stackrel{-H_{2}O}{→}$RCH=CHCHO
$\stackrel{-H_{2}O}{→}$RCH=CHCHO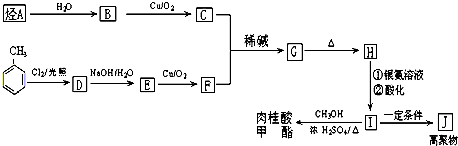

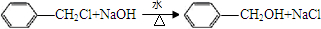
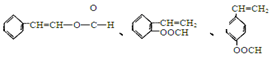
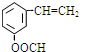 、
、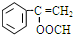 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 1mol/LFeCl3溶液中含有0.1NA个Fe3+ | |
| B. | 1.06g Na2CO3含有的CO32-离子数小于0.01 NA | |
| C. | PH=3的醋酸溶液中,含有的H+数为0.001NA | |
| D. | 2L 0.5mol/L的氨水中,含有NH3•H2O、NH4+、NH3的总数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol任何物质体积均为22.4L | |
| B. | CH4的摩尔质量为16g | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 1 mol H2O的质量为18g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾的化学式为Al2(SO4)3•12H2O | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | AlCl3溶液与浓氨水反应有白色沉淀生成 | |
| D. | Al是重要的金属元素,其对应的氧化物为碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com