
| A. | 标准状况下,1 mol任何物质体积均为22.4L | |
| B. | CH4的摩尔质量为16g | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 1 mol H2O的质量为18g/mol |
分析 A、根据标准状况条件下1mol气体体积为22.4L;
B、摩尔质量的单位为g/mol;
C、3.01×1023个SO2分子即0.5molSO2的质量为0.5×64g=32g;
D、质量的单位为克.
解答 解:A、根据标准状况条件下1mol气体体积为22.4L,而不是任何物质,故A错误;
B、摩尔质量的单位为g/mol,所以CH4的摩尔质量为16g/mol,故B错误;
C、3.01×1023个SO2分子即0.5molSO2的质量为0.5×64g=32g,故C正确;
D、质量的单位为克,所以1 mol H2O的质量为18g,故D错误;
故选C.
点评 本题考查想对物质的量的有关知识的理解与在解题中应用的能力.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题
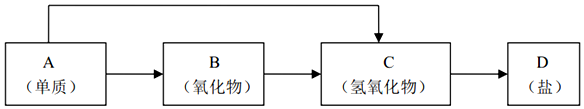
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫原子:${\;}_{16}^{34}S$ | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | H2O2的电子式: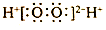 | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
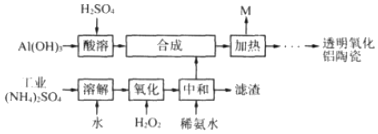
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①②③ | C. | ②③④⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释到原体积的10倍,溶液的pH=4 | |
| B. | 加水稀释,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变,n(OH-)增大 | |
| C. | 加入10 mL pH=11的NaOH溶液,所得混合液的pH=7 | |
| D. | 加入少量醋酸钠固体,则平衡CH3COOH?CH3COO-+H+逆向移动,K变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应一定是氧化还原反应 | |
| B. | 有单质参加的反应一定是氧化还原反应 | |
| C. | 分解反应可能是氧化还原反应 | |
| D. | 凡是氧化还原反应都不可能是复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com