
| A. | 含1个双键的环状有机物 | B. | 含2个双键的直链有机物 | ||
| C. | 只含有1个双键的直链有机物 | D. | 含一个三键的直链有机物 |
科目:高中化学 来源: 题型:选择题
| A. | 0.5Q | B. | Q | C. | 2Q | D. | 5Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可溶性铁盐或铝盐可用于水的净化 | |
| B. | 电解MgCl2溶液可制得金属镁 | |
| C. | 在海轮的外壳镶上锌块,可减缓船体的腐蚀速率 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
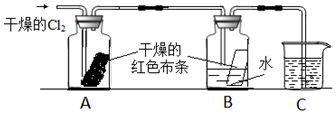
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
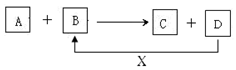 A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.
A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系.(图中反应条件略去)填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | abc | B. | bcd | C. | acd | D. | abcd |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
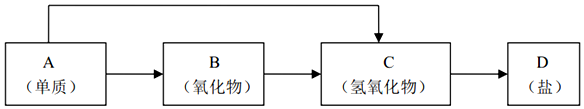
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
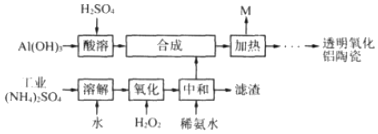
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com