
| A. | ②③⑤⑦ | B. | ①②③⑥⑦ | C. | ①②④⑦ | D. | ②③⑤⑥⑦ |
分析 ①金属的化学腐蚀中没有电流产生;
②银和硫化氢反应生成黑色的硫化银;
③电解池的阴极材料得到保护,阳极材料被腐蚀;
④电化学腐蚀中活泼金属作负极;
⑤电化学腐蚀时金属失电子被腐蚀;
⑥作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护;
⑦海轮外壳连接锌块,锌为负极.
解答 解:①金属的化学腐蚀中没有电流产生,电化腐蚀过程中形成的原电池反应会产生微弱的电流,故错误;
②由于是纯银器,故不能形成微电池,故在空气中逐渐变暗是发生了化学发生,故正确;
③地下输油钢管与外加直流电源的负极相连,该金属做电解池的阴极材料,可以得到保护,故正确;
④发生化学能转变为电能的腐蚀,即发生电化学腐蚀,电化学腐蚀中活泼金属作负极失电子被腐蚀,故错误;
⑤电化学腐蚀时金属失电子被腐蚀,发生电化学腐蚀时都会有能量转化,如化学能转化为电能、热能等,故正确;
⑥铁、锡和电解质溶液能构成原电池,铁易失电子发生氧化反应而作负极,锡作正极,所以镀层对铁制品不起保护作用,故错误;
⑦海轮外壳连接锌块,锌为负极,保护外壳不受腐蚀,为牺牲阳极的阴极保护法,故正确;
故选A.
点评 本题考查化学腐蚀与电化腐蚀原理的分析应用,金属腐蚀和金属的保护是考试的重点,题目难度中等,侧重于原电池原理的应用的考查.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molBr-完全转化为BrO3-,得到6 mol电子 | |
| B. | 该过程中溴化物发生氧化反应,臭氧发生还原反应 | |
| C. | 该过程中溴元素被还原,氧元素被氧化 | |
| D. | 该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤油污常用热的碳酸钠溶液 | |
| B. | 无法利用Na2S溶液和AlCl3溶液制备Al2S3 | |
| C. | 金属焊接中,可用NH4Cl溶液作除锈剂 | |
| D. | 工业上用FeCl3溶液腐蚀铜制印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2与水反应,转移电子1 mol | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应的产物也相同 | |
| C. | 钠能与氧气和水反应,钠暴露在空气中最终的产物是NaOH | |
| D. | 将Na2O2加入酚酞试液中,得到红色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C3H4 | C. | C3H8 | D. | C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
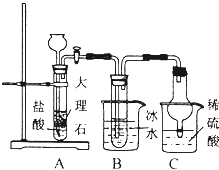 氨气是重要的化工原料.
氨气是重要的化工原料.| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
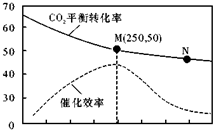 一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)>v(N) | |
| B. | 平衡常数KM<KN | |
| C. | 催化剂可能会影响CO2的平衡转化率 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,CO2的体积分数约为15.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
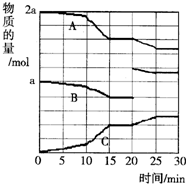
| A. | 10~15 min可能是扩大了容器体积 | B. | 10~15 min可能是降低了温度 | ||
| C. | 20 min时可能是缩小了容器体积 | D. | 20 min时可能是增加了B的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com