
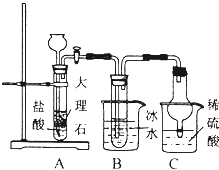
 氨气是重要的化工原料.
氨气是重要的化工原料.| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
分析 (1)浓氨水与碱混合可制备氨气;
(2)由图可知,A中碳酸钙与盐酸反应生成CO2,B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和,B中冰水可降低温度,B中发生NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3,C中吸收过量的氨气且可防止倒吸,该装置中盐酸易挥发,与碳酸氢钠反应,结合NaCl~NaHCO3计算;
(3)[Cu(NH3)4]2+ (深蓝色)+4H+?Cu2+(蓝色)+4NH4+中氢离子浓度影响平衡移动,结合颜色变化分析.
解答 解:(1)烧碱、生石灰、碱石灰均与氨水混合可快速制备氨气,而氯化铵与氨水混合不能制备氨气,故答案为:abd;
(2)①C装置的作用为防倒吸、吸收过量氨气防污染,
故答案为:防倒吸、吸收过量氨气防污染;
②由表格数据可知,B装置中使用冰水的目的是低温便于析出碳酸氢钠,
故答案为:低温便于析出碳酸氢钠;
③盐酸挥发干扰实验,应除去HCl,则在AB装置之间连接一个盛有饱和碳酸氢钠溶液的洗气瓶,其作用为 除去二氧化碳气体中的氯化氢气体,
故答案为:AB;饱和碳酸氢钠溶液;除去二氧化碳气体中的氯化氢气体;
④由NaCl~NaHCO3可知,理论上生成NaHCO3为$\frac{11.7g}{58.5g/mol}$×84g/mol=16.8g,实验后得到干燥NaHCO3晶体质量为10.92g,则NaHCO3的产率为$\frac{10.92g}{16.8g}$×100%=65%,故答案为:65%;
(3)实验证明平衡I是否存在的方法为往深蓝色溶液中通入少量HCl气体若溶液颜色变浅,证明有平衡Ⅰ的存在,否则不存在(或通入少量氨气或加少量NaOH固体,若溶液颜色变深证明平衡Ⅰ的存在,否则不存在),
故答案为:往深蓝色溶液中通入少量HCl气体若溶液颜色变浅,证明有平衡Ⅰ的存在,否则不存在(或通入少量氨气或加少量NaOH固体,若溶液颜色变深证明平衡Ⅰ的存在,否则不存在).
点评 本题考查物质的制备实验,为高频考点,把握制备原理、实验装置的作用、混合物分离、实验技能为解答的关键,注意(3)中平衡移动原理的应用,侧重分析与实验能力的考查,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | 向水中加入少量稀硫酸,c(H+)增大,KW不变 | |
| C. | 向水中加入氨水,水的电离平衡向正反应方向移动,c(OH-)增大 | |
| D. | pH=3的醋酸溶液,稀释至10倍后pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
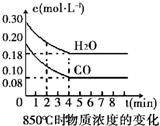
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑦ | B. | ①②③⑥⑦ | C. | ①②④⑦ | D. | ②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
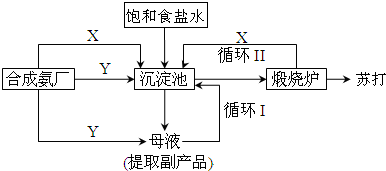
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
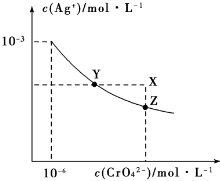 t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点 | |
| B. | 在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃ | |
| C. | 向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点 | |
| D. | 在t℃时,Ag2CrO4的Ksp为1×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| B. | 向BaCl2溶液中加入AgNO3和KI,当两种沉淀共存时,$\frac{c({I}^{-})}{c(C{l}^{-})}$=5.6×10-7 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | AgCl不溶于水,不能转化为AgI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com