
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | 向水中加入少量稀硫酸,c(H+)增大,KW不变 | |
| C. | 向水中加入氨水,水的电离平衡向正反应方向移动,c(OH-)增大 | |
| D. | pH=3的醋酸溶液,稀释至10倍后pH=4 |
分析 A.无论pH大小,纯水都呈中性;
B.水中加入稀硫酸,c(H+)增大,离子积常数只与温度有关;
C.向水中加入氨水,c(OH-)增大,抑制水电离;
D.醋酸是弱电解质,醋酸溶液中存在电离平衡.
解答 解:A.无论pH大小,纯水都呈中性,95℃纯水的pH<7,但纯水仍然呈中性,故A错误;
B.水中加入稀硫酸,c(H+)增大,离子积常数只与温度有关,温度不变,水的离子积常数不变,故B正确;
C.向水中加入氨水,c(OH-)增大,抑制水电离,水的电离平衡逆向移动,故C错误;
D.醋酸是弱电解质,醋酸溶液中存在电离平衡,所以pH=3的醋酸溶液,稀释至10倍后溶液中氢离子浓度大于原来的$\frac{1}{10}$,所以稀释有溶液的pH<4,故D错误;
故选B.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点、水电离影响因素是解本题关键,注意:离子积常数只与温度有关,与溶液酸碱性及物质溶解性强弱无关,易错选项是A.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的稀溶液混合,放出的热量等于57.3 kJ | |
| B. | 已知正丁烷(g)→异丁烷(g)△H<0,则正丁烷比异丁烷稳定 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加C,B的平衡转化率不变 | |
| B. | 此时,B的平衡转化率是35% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | Na2O+H2O═2NaOH | ||
| C. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2:7或5:4 | B. | 2:1或5:4 | C. | 4:5或7:2 | D. | 2:1或7:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ①③⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molBr-完全转化为BrO3-,得到6 mol电子 | |
| B. | 该过程中溴化物发生氧化反应,臭氧发生还原反应 | |
| C. | 该过程中溴元素被还原,氧元素被氧化 | |
| D. | 该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
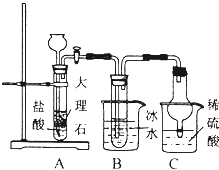 氨气是重要的化工原料.
氨气是重要的化工原料.| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com