
【题目】电解原理在化学工业中有着广泛的应用。如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同,A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
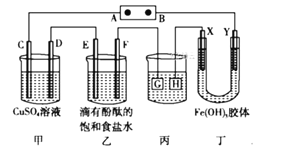
(1)外接直流电源中A为____极,甲中电解时的化学反应方程式为__________,通过一段时间后向所得溶液中加入0.2molCu(OH)2粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为______________。
(2)现用丙装置给铜件镀银,H为______(填“镀件”还是“镀层”),当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________。
(3)电解一段时间后,发现丁中Y极附近溶液红褐色加深,则Fe(OH)3胶粒带____(填“正”或“负”)电荷。
【答案】正 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 0.8mol 镀件 5.4g 正
2Cu+O2↑+2H2SO4 0.8mol 镀件 5.4g 正
【解析】
将直流电源接通后,F极附近呈红色,可知道氢离子在该电极放电,所以F是阴极,E是阳极,则电源电极A是正极,B是负极,并得到其他各个电极的名称,在同一串联电路中电子转移数目相等,结合电镀要求判断镀件、镀层;对于Fe(OH)3胶体来说,胶粒带正电荷,会向负电荷较多的电极方向移动,据此分析解答。
将直流电源接通后,F极附近呈红色,说明F极显碱性,是溶液中H+在该电极放电,所以F电极是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极。
(1)根据上述分析可知:A是电源正极,B是电源的负极,在甲中,C是阳极,D是阴极。在该溶液中阴离子有OH-、SO42-,放电能力:OH->SO42-, C电极发生反应:4OH--4e-=O2↑+2H2O;阳离子有Cu2+、H+,放电能力Cu2+>H+,所以在D电极发生反应:Cu2++2e-=Cu,电解时总反应方程式为:2Cu2++2H2O![]() 2Cu+O2↑+4H+,电解的化学反应方程式为2CuSO4+2H2O
2Cu+O2↑+4H+,电解的化学反应方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,通电后加入0.2molCu(OH)2(相当于CuO和H2O)后溶液与电解前相同,根据铜元素守恒,所以析出金属铜的物质的量是0.2mol,阴极反应是:2Cu2++4e-→2Cu,当析出金属铜的物质的量是0.2mol时,则转移的电子是0.4mol,当电解掉0.2mol水时,转移电子是0.4mol,总共转移电子是0.8mol;
2Cu+O2↑+2H2SO4,通电后加入0.2molCu(OH)2(相当于CuO和H2O)后溶液与电解前相同,根据铜元素守恒,所以析出金属铜的物质的量是0.2mol,阴极反应是:2Cu2++4e-→2Cu,当析出金属铜的物质的量是0.2mol时,则转移的电子是0.4mol,当电解掉0.2mol水时,转移电子是0.4mol,总共转移电子是0.8mol;
(2)电镀装置中,镀层金属必须作阳极连接电源的正极,镀件作阴极,连接电源的负极,所以丙装置中H应该是镀件,G是镀层金属。当乙中溶液的pH是13时(此时乙溶液体积为500mL)时,根据电极反应2H++2e-=H2↑,则放电的氢离子的物质的量为:0.1mol/L×0.5L=0.05mol,转移电子的物质的量为0.05mol电子时,丙中镀件上析出银的质量m(Ag)= 0.05mol× 108g/mol=5.4g;
(3)电源B电极为负极,则Y电极为阴极,阴极上负电荷较多,电解一段时间后,发现丁中Y极附近溶液红褐色加深,根据同种电荷相互排斥,异种电荷相互吸引的原则,说明Fe(OH)3胶粒带正电荷。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】如图所示是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MHNi电池)。下列有关说法不正确的是

A. 放电时正极反应为NiOOH+H2O+e-→Ni(OH)2+OH-
B. 电池的电解液可为KOH溶液
C. 充电时负极反应为MH+OH-→H2O+M+e-
D. MH是一类储氢材料,其氢密度越大,电池的能量密度越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
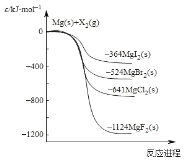
A.热稳定性:MgF2 <MgCl2<MgBr2<MgI2
B.22.4LF2(g)与足量的Mg充分反应,放热1124kJ
C.工业上可由电解MgCl2溶液冶炼金属Mg,该过程需要吸收热量
D.由图可知:MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) H<-117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
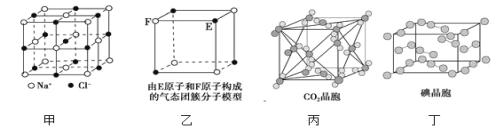
A.在NaCl晶体(图甲)中,距Na+最近的C1-围成正八面体
B.该气态团簇分子(图乙)的分子式为EF或FE
C.在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D.在碘晶体(图丁)中,存在的作用力有非极性共价键和范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3,则Co3O4与浓盐酸反应能生成黄绿色气体的离子方程式_________________。
(2)碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
已知25℃,101kPa时: 4Fe(s)+3O2(g)=2Fe2O3(s) △H=1648kJ/mol
C(s)+O2(g)=CO2(g) △H=393kJ/mol
2FeCO3(s)=2Fe(s)+2C(s)+3O2(g) △H=+1480kJ/mol
写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式______________。
(3)将标准状况下1.344L Cl2通入100mL0.5mol/lFeI2溶液中的离子方程式为_____________。
(4)1mol·L-1的NaAlO2溶液和3.0mol·L-1的HCl溶液等体积混合的离子方程式为________________
(5)用于驱动潜艇的液氨-液氧燃料电池示意图如图所示:
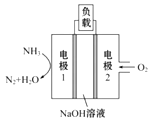
则电极1的电极反应式为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a. 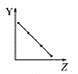 b.
b. 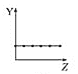 c.
c. 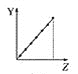 d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质G可做香料,其结构简式为![]() ,工业合成路线如下:
,工业合成路线如下:

已知:
Ⅰ. 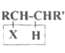
![]() RCH=CHR'
RCH=CHR'
Ⅱ.RCH2X+NaOH![]() RCH2OH+NaX
RCH2OH+NaX
(R、R'为烃基或H原子,X为卤素原子)
回答下列问题:
(1)A为芳香烃,相对分子质量为78。下列关于A的说法中,正确的是____(填序号)。
a.密度比水大
b.所有原子均在同一平面上
c.一氯代物只有一种
(2)反应①的反应类型为__________反应。
(3)C的核磁共振氢谱显示有4组峰,步骤②的化学方程式是__________。
(4)③的反应条件是__________。
(5)④为加成反应,E的核磁共振氢谱显示有6组峰,步骤④的化学方程式是_______。
(6)步骤⑤的化学方程式是__________。
(7)下列说法正确的是__________。
a.上述框图中方框内所有物质均为芳香族化合物
b.D存在顺反异构
c.反应②和⑤都是取代反应
(8)反应⑥中Cu是反应的催化剂,该反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]()
(1)只含有离子键的是______(填序号,下同)
(2)含有共价键的离子化合物是______,其中含有非极性共价键的物质的电子式为______。
(3)属于共价化合物的是______。
(4)熔融状态下能导电的化合物是______。
(5)熔融状态下和固态时都能导电的物质是______。
(6)用电子式表示![]() 的形成过程:______。
的形成过程:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.丙烷和丁烷是同系物,两者化学性质相似
B.![]() 和
和![]() 互为同分异构体,两者化学性质不同
互为同分异构体,两者化学性质不同
C.氧气和臭氧互为同素异形体,两者的熔点不同
D.氧化钠与过氧化钠均为离子化合物,两者所含的化学键类型不完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com