
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
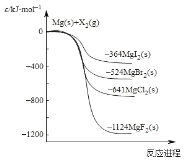
A.热稳定性:MgF2 <MgCl2<MgBr2<MgI2
B.22.4LF2(g)与足量的Mg充分反应,放热1124kJ
C.工业上可由电解MgCl2溶液冶炼金属Mg,该过程需要吸收热量
D.由图可知:MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) H<-117kJ/mol
【答案】D
【解析】
A.物质含有的能量越低,物质的稳定性就越强,根据图示可知,物质的稳定性MgF2 >MgCl2>MgBr2>MgI2,A错误;
B.未指明气体所处的条件,因此不能计算反应放出的热量,B错误;
C.由于MgCl2(s)的能量比Mg(s)、Cl2(g)低,所以工业上可由电解熔融MgCl2冶炼金属Mg,该过程需要吸收热量,C错误;
D.根据图示可知①MgCl2(s)=Mg(s)+Cl2(g)△H=+641kJ/mol,②MgBr2(s)=Mg(s)+Br2(g)△H=+524kJ/mol,②-①,整理可得MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g) H=-117kJ/mol,物质由气态变为液态,会放出热量,所以MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) H<-117kJ/mol,D正确;
故合理选项是D。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】已知工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3~0.5 g。已知NaNO2能发生如下反应(离子方程式已配平):2![]() +xI-+yH+
+xI-+yH+![]() 2NO↑+I2+zH2O,请回答下列问题:
2NO↑+I2+zH2O,请回答下列问题:
(1)上述反应中,x=___,y=____,z=___,氧化剂是____。
(2)某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是___。
A.NaCl B.KMnO4 C.浓硫酸 D.NH4Cl
(3) 饮用水中的![]() 对人类健康会产生危害, 碱性条件下还生成Na[Al(OH)4],为了降低饮用水中的
对人类健康会产生危害, 碱性条件下还生成Na[Al(OH)4],为了降低饮用水中的![]() 浓度,某饮用水研究人员提出,在碱性条件下用铝粉将还原
浓度,某饮用水研究人员提出,在碱性条件下用铝粉将还原![]() 为N2,请配平化学方程式:___Al+__NaNO3+__NaOH
为N2,请配平化学方程式:___Al+__NaNO3+__NaOH![]() __+__N2↑+__H2O,若反应过程中转移0.5 mol电子,则生成标准状况下的N2体积为____。
__+__N2↑+__H2O,若反应过程中转移0.5 mol电子,则生成标准状况下的N2体积为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是( )
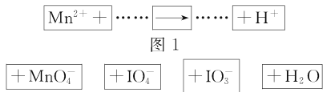
A.![]() 作氧化剂B.若有
作氧化剂B.若有![]() 参加反应转移
参加反应转移![]() 电子
电子
C.氧化剂与还原剂的物质的量之比为5∶2D.配平后![]() 、
、![]() 的化学计量数分别为2、3
的化学计量数分别为2、3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点(最中心的点)代表起点元素。下列正确的是( )
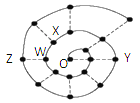
A.物质YO可能具有较强的氧化性
B.图中离O点越远的元素,其原子半径一定越大
C.O2X、WO3分子内都含有氢键,所以沸点都较高
D.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的Z元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,物质①4gH2,②33.6LCH4,③1molH2O,④3.01×1023个O2.含分子数最多的是(填序号,下同)___,含原子数最少的是___,质量最大的是___,体积最小的是____。
(2)写出过氧化钠和水反应的化学方程式___
(3)在上述反应中,氧化剂是________,还原剂是______,每有1mol过氧化钠反应,则转移电子个数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )

A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有着广泛的应用。如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同,A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
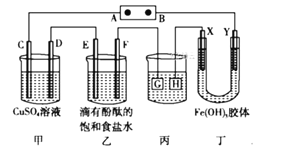
(1)外接直流电源中A为____极,甲中电解时的化学反应方程式为__________,通过一段时间后向所得溶液中加入0.2molCu(OH)2粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为______________。
(2)现用丙装置给铜件镀银,H为______(填“镀件”还是“镀层”),当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________。
(3)电解一段时间后,发现丁中Y极附近溶液红褐色加深,则Fe(OH)3胶粒带____(填“正”或“负”)电荷。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y均为短周期元素,且![]() 比
比![]() 的电子层数多,下列说法正确的是( )
的电子层数多,下列说法正确的是( )
A.Y可能是第一周期元素
B.X和Y一定位于相邻的两个周期
C.a一定比b小
D.a+m+n-b的值一定为8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com