
【题目】(1)在标准状况下,物质①4gH2,②33.6LCH4,③1molH2O,④3.01×1023个O2.含分子数最多的是(填序号,下同)___,含原子数最少的是___,质量最大的是___,体积最小的是____。
(2)写出过氧化钠和水反应的化学方程式___
(3)在上述反应中,氧化剂是________,还原剂是______,每有1mol过氧化钠反应,则转移电子个数为____。
【答案】① ④ ② ③ ![]()
![]()
![]()
![]()
【解析】
(1)先将不同的表述统一成物质的量,n(H2)=![]() 、n(CH4)=
、n(CH4)=![]() 、n(O2)=
、n(O2)=![]() ,则分子数最多的是①;
,则分子数最多的是①;
氢气是双原子分子,2mol氢气一共有4mol原子,甲烷是五原子分子,1.5mol甲烷一共有7.5mol原子,水是三原子分子,1mol水一共有3mol原子,氧气是双原子分子,0.5mol氧气一共有1mol原子,综上可知,原子数最少的是④;
根据![]() 计算各物质的质量,1.5mol甲烷的质量为24g,1mol水的质量为18g,0.5mol氧气的质量为16g,因此质量最大的为②;
计算各物质的质量,1.5mol甲烷的质量为24g,1mol水的质量为18g,0.5mol氧气的质量为16g,因此质量最大的为②;
①②④均为气体,标准状况下体积分布为44.8L、33.6L、11.2L,而18g水大约只有18mL,因此③的体积最小;
(2)过氧化钠和水反应的方程式为![]() ;
;
(3)过氧化钠中的氧元素化合价发生改变,一部分从-1价升高到0价,一部分从-1价降低到-2价,属于歧化反应,因此氧化剂和还原剂均为![]() ,根据方程式不难看出,每有2mol
,根据方程式不难看出,每有2mol![]() 发生反应,转移2mol电子,则参加反应的过氧化钠和转移电子数之比为1:1,因此答案为
发生反应,转移2mol电子,则参加反应的过氧化钠和转移电子数之比为1:1,因此答案为![]() 。
。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分 CuFeS2)制取 FeSO4·7H2O 和Cu的主要流程如下:

(1)检验酸浸过程中 Fe2+是否被氧化,应选择________(填字母编号)。
A.KMnO4 溶液 B.K3[Fe(CN)6]溶液 C.KSCN 溶液
(2)酸浸过程中主要反应的化学方程式为__________。
(3)某同学向盛有 H2O2 溶液的试管中加入几滴酸化的 FeSO4 溶液,溶液变成棕黄色,发生反应的离子方程式为___________。一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成;产生气泡的原因是_________,生成沉淀的原因是___________(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaC1O3可用于制取二氧化氯、亚氯酸钠及高氯酸盐等。以原盐(主要成分为NaC1)为原料制备氯酸钠的工艺流程如下:

已知:Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。
回答下列问题:
(1)“粗制盐水”中加入NaOH和Na2CO3的目的是___________________。
(2)过滤时,使用的玻璃仪器有烧杯、玻璃棒和____________。
(3)在pH:6.4~6.8,温度:40~50℃的条件下电解,理论上最终产物只有NaC1O3。电解时阳极的产物为C12,溶液中发生的反应有C12+H2O====HC1O+H++C1-,HC1O![]() H++C1O-和__________。
H++C1O-和__________。
(4)电解槽中温度不宜过高,其原因是_________________________。加入的Na2Cr2O7可以调节电解液酸度,若酸度过大,则电解液中主要存在__________(填“Cr2O72-”或“CrO42-”)。
(5)为检测电解后盐水中NaC1O3的物质的量浓度进行下列实验:
I.准确吸取10.00mL电解后的盐水,加入适量的3%H2O2溶液充分搅拌并煮沸。
Ⅱ.准确吸取0.10mol·L-1的(NH4)2Fe(SO4)2标准溶液25.00 mL于300mL锥形瓶中,加入足量稀硫酸。
III.将I的溶液加入Ⅱ的锥形瓶中,隔绝空气煮沸10min,加热充分反应。冷却至室温后,加入10mL0.4mol·L-1MnSO4溶液、5mL 85%磷酸溶液,用c mol·L-1的KMnO4标准溶液滴定剩余的Fe2+至溶液变为微红色,即滴定终点,此时消耗高锰酸钾V mL。
①步骤I中加入H2O2溶液的作用是______________________。
②步骤Ⅱ中C1O3-被Fe2+还原为C1-的离子方程式为________________________。
③该盐水中NaC1O3的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。下列叙述错误的是( )
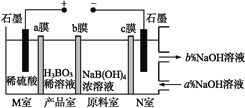
A. M室发生的电极反应式:2H2O-4e-![]() O2↑+4H+
O2↑+4H+
B. N室:a<b
C. 产品室发生的反应是B(OH)4- +H+![]() H3BO3+H2O
H3BO3+H2O
D. 理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
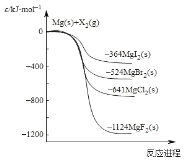
A.热稳定性:MgF2 <MgCl2<MgBr2<MgI2
B.22.4LF2(g)与足量的Mg充分反应,放热1124kJ
C.工业上可由电解MgCl2溶液冶炼金属Mg,该过程需要吸收热量
D.由图可知:MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) H<-117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
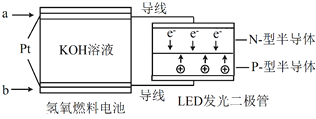
A. 电路中的电子从负极经外电路到正极,再经过KOH溶液回到负极,形成闭合回路
B. a处通入氢气, b处通氧气,该装置将化学能最终转化为电能
C. 电池放电后, OH-的物质的量浓度减小
D. 通入O2的电极发生反应:O2 + 4e- = 2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
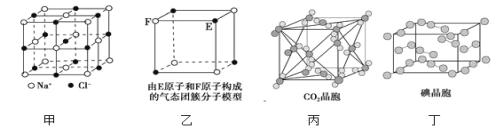
A.在NaCl晶体(图甲)中,距Na+最近的C1-围成正八面体
B.该气态团簇分子(图乙)的分子式为EF或FE
C.在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D.在碘晶体(图丁)中,存在的作用力有非极性共价键和范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水只作为还原剂的是( )
A.3Fe+4H2O(g)![]() Fe3O4+4H2B.2H2O
Fe3O4+4H2B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2Na2O2+2H2O═4NaOH+O2↑D.2F2+2H2O═4HF+O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com