
【题目】回答下列问题
(1)已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3,则Co3O4与浓盐酸反应能生成黄绿色气体的离子方程式_________________。
(2)碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
已知25℃,101kPa时: 4Fe(s)+3O2(g)=2Fe2O3(s) △H=1648kJ/mol
C(s)+O2(g)=CO2(g) △H=393kJ/mol
2FeCO3(s)=2Fe(s)+2C(s)+3O2(g) △H=+1480kJ/mol
写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式______________。
(3)将标准状况下1.344L Cl2通入100mL0.5mol/lFeI2溶液中的离子方程式为_____________。
(4)1mol·L-1的NaAlO2溶液和3.0mol·L-1的HCl溶液等体积混合的离子方程式为________________
(5)用于驱动潜艇的液氨-液氧燃料电池示意图如图所示:
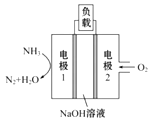
则电极1的电极反应式为:______________。
【答案】Co3O4+8H++2Cl-=3Co2++Cl2↑+4H2O 4FeCO3(s)+O2(g) =2Fe2O3(s)+4CO2(g) △H=-260kJ/mol 6Cl2+10I-+2Fe2+=12Cl-+5I2+2Fe3+ 3AlO2-+9H+=Al(OH)3↓+2Al3++3H2O 2NH3-6e-+6OH-=N2+6H2O
【解析】
(1)Co3O4与浓盐酸反应,能生成黄绿色气体氯气,同时得到还原产物氯化钴,据此回答;
(2)FeCO3在空气中煅烧生成Fe2O3、CO2,将已知热化学方程式叠加,可得该反应的热化学方程式;
(3)先计算Cl2的物质的量,然后利用还原性I->Fe2+,根据微粒的物质的量多少,还原性强的先反应,然后是还原性弱的后反应,书写离子方程式;
(4)二者的物质的量比为1:3,转化为沉淀时以1:1反应,沉淀溶解时,沉淀与酸以1:3反应,生成铝离子;
(5)该装置是原电池,在电极1上NH3失去电子,发生氧化反应,结合溶液中的OH-书写电极反应式。
(1)Co3O4与浓盐酸反应,能生成黄绿色气体氯气,同时得到还原产物氯化钴,发生反应的离子方程式为:Co3O4+8H++2Cl-=3Co2++Cl2↑+4H2O;
(2)在空气中加热FeCO3可以和氧气反应得到黑色Fe2O3,即4FeCO3+O2![]() 2Fe2O3+4CO2,
2Fe2O3+4CO2,
①4Fe(s)+3O2(g)=2Fe2O3(s) △H1=1648kJ/mol
②C(s)+O2(g)=CO2(g) △H2=393kJ/mol
③2FeCO3(s)=2Fe(s)+2C(s)+3O2(g) △H3=+1480kJ/mol
①+4×②+2×③,整理可得4FeCO3(s)+O2(g) =2Fe2O3(s)+4CO2(g) △H=△H1+4×△H2+2×△H3=-260kJ/mol;
(3)n(Cl2)= 1.344L÷22.4L/mol=0.06mol,n(FeI2)=c·V=0.5mol/L×0.1L=0.05mol,n(Fe2+)=0.05mol,n(I-)=2n(FeI2)=0.1mol,由于还原性:I->Fe2+,首先发生反应:Cl2+2I-=2Cl-+I2,0.1molmolI-反应消耗0.05molCl2,还剩余0.01molCl2,发生反应Cl2+2Fe2+=2Cl-+Fe3+,0.01molCl2反应消耗0.02molFe2+,所以反应的离子方程式为6Cl2+10I-+2Fe2+=12Cl-+5I2+2Fe3+;
(4)假设溶液的体积为3L,则溶液中含有n(NaAlO2)=3.0mol,n(HCl)=9.0mol,首先发生反应:
AlO2-+H++H2O=Al(OH)3↓,AlO2-反应完全,H+消耗3mol,产生3mol Al(OH)3,还剩余6mol,发生反应:Al(OH)3+3H+=Al3++3H2O,6molH+反应会消耗2mol Al(OH)3,产生2mol Al3+,剩余1mol Al(OH)3,则1mol·L-1的NaAlO2溶液和3.0mol·L-1的HCl溶液等体积混合的离子方程式为3AlO2-+9H+=Al(OH)3↓+2Al3++3H2O;
(5)在电极1上NH3失去电子,变为N2,则电极1的电极反应式为2NH3-6e-+6OH-=N2+6H2O。


科目:高中化学 来源: 题型:
【题目】某烃的结构简式如图,下列说法不正确的是
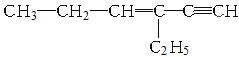
A.1mol该烃完全燃烧消耗O2 11molB.与氢气完全加成后的产物中含2个甲基
C.1mol该烃完全加成消耗Br2 3molD.分子中一定共平面的碳原子有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点(最中心的点)代表起点元素。下列正确的是( )
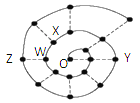
A.物质YO可能具有较强的氧化性
B.图中离O点越远的元素,其原子半径一定越大
C.O2X、WO3分子内都含有氢键,所以沸点都较高
D.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的Z元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )

A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有着广泛的应用。如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同,A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
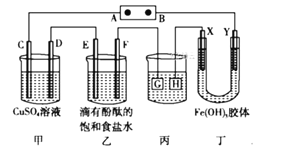
(1)外接直流电源中A为____极,甲中电解时的化学反应方程式为__________,通过一段时间后向所得溶液中加入0.2molCu(OH)2粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为______________。
(2)现用丙装置给铜件镀银,H为______(填“镀件”还是“镀层”),当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________。
(3)电解一段时间后,发现丁中Y极附近溶液红褐色加深,则Fe(OH)3胶粒带____(填“正”或“负”)电荷。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确解释下列反应原理,并且书写的离子方程式正确的是( )
A.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C.电解MgCl2饱和溶液制取Mg:MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
D.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-=CaCO3+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在同一碳原子上连有两个羟基的化合物是极不稳定的,它要自动失水生成含醛基的化合物。今在无其他氧化剂存在的条件下,以甲苯和氯气为主要原料按下列过程制取苯甲醛(C6H5CHO)。
![]()
(1)条件2中试剂为____________________________________________。
(2)写出苯甲醛与新制Cu(OH)2悬浊液反应的化学方程式:_________________________________________________________________。
(3)苯甲醛在强碱性条件下可发生自身氧化还原反应,即部分氧化成羧酸盐A,部分还原成醇B。写出A经酸化后的产物苯甲酸与B酯化反应可生成一种新的化合物C的结构简式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com