
【题目】已知在同一碳原子上连有两个羟基的化合物是极不稳定的,它要自动失水生成含醛基的化合物。今在无其他氧化剂存在的条件下,以甲苯和氯气为主要原料按下列过程制取苯甲醛(C6H5CHO)。
![]()
(1)条件2中试剂为____________________________________________。
(2)写出苯甲醛与新制Cu(OH)2悬浊液反应的化学方程式:_________________________________________________________________。
(3)苯甲醛在强碱性条件下可发生自身氧化还原反应,即部分氧化成羧酸盐A,部分还原成醇B。写出A经酸化后的产物苯甲酸与B酯化反应可生成一种新的化合物C的结构简式:______________________。
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3,则Co3O4与浓盐酸反应能生成黄绿色气体的离子方程式_________________。
(2)碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
已知25℃,101kPa时: 4Fe(s)+3O2(g)=2Fe2O3(s) △H=1648kJ/mol
C(s)+O2(g)=CO2(g) △H=393kJ/mol
2FeCO3(s)=2Fe(s)+2C(s)+3O2(g) △H=+1480kJ/mol
写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式______________。
(3)将标准状况下1.344L Cl2通入100mL0.5mol/lFeI2溶液中的离子方程式为_____________。
(4)1mol·L-1的NaAlO2溶液和3.0mol·L-1的HCl溶液等体积混合的离子方程式为________________
(5)用于驱动潜艇的液氨-液氧燃料电池示意图如图所示:
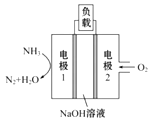
则电极1的电极反应式为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2固体(溶液体积变化、温度变化忽略不计),测得溶液中离子浓度的关系如图所示,下列说法正确的是( )
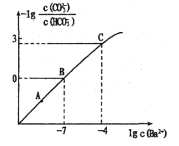
已知:Ksp(BaCO3)=2.40![]() 10-9
10-9
A.A、B、C三点对应溶液pH的大小顺序为:A>B>C
B.A点对应的溶液中存在:c(CO32-)< c(HCO3-)
C.B点溶液中 c(CO32-)=0.24mol/L
D.向C点溶液中通入CO2可使C点溶液向B点溶液转化
查看答案和解析>>
科目:高中化学 来源: 题型:
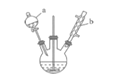
【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。
已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子质量 | 溶解性 |
苯甲醛 | 178.1 | 1.04 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.04 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |
实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9-10后,加入3.0mL苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到2.08g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
(4)步骤②中,应选用的实验装置是___(填序号),该操作中分离出有机相的具体操作方法是___。
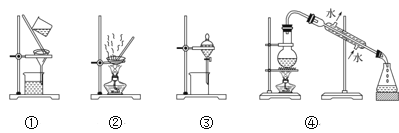
(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用图甲装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用__(填序号)。
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.氯化钙
(2)若探究氨气的溶解性,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是__。不能在K2的导管末端连接图乙中的__装置(填序号)。
(3)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成的气体必须依次通过盛有__试剂和__试剂的洗气瓶。
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为__。
③尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放__溶液(填化学式),反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.丙烷和丁烷是同系物,两者化学性质相似
B.![]() 和
和![]() 互为同分异构体,两者化学性质不同
互为同分异构体,两者化学性质不同
C.氧气和臭氧互为同素异形体,两者的熔点不同
D.氧化钠与过氧化钠均为离子化合物,两者所含的化学键类型不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用化合物A模拟工业上制备含氧酸D的过程如图所示,已知D为强酸,请回答下列问题。
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了_____而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A的化学式是_________;C的化学式是_______。
②D的浓溶液在常温下可与铜反应并生成C气体,反应的化学方程式是____,该反应______(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
编号 | 基本信息 | 解决的问题 |
① | 其中两种元素的原子核外电子层数与最外层电子数之比分别为 | 这两种元素分别是______(填元素符号,下同)、______. |
② | 其中一种元素的氧化物与强酸、强碱均能反应;另一种元素的单质、氧化物及氧化物对应的水化物均能与NaOH溶液反应 | 这两种元素分別是______、______. |
③ | G能与A、E分别形成原子个数比均为 | X的分子式为______, |
(1)仅由表中信息还不能确定的元素是______(填字母序号),若要确定其是何种元素,还需要的条件是______(填序号).
a.单质能与氧气反应
b.最高价氧化物对应的水化物是强酸
e.单质在常温下为固体
d.简单氯化物的稳定性比![]() 的简单氯化物强
的简单氯化物强
(2)基本信息②中,两种元素的氧化物分别与NaOH溶液反应的离子方程式为__________________,__________________.
(3)上述某两种元素间可形成原子个数比为![]() 及
及![]() 的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.
的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com