
| A. | 3:4:1 | B. | 3:1:2 | C. | 7:2:1 | D. | 9:3:1 |
分析 CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应.2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;氢气燃烧2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,相当于是H2、CO与过氧化钠直接发生化合反应;只要C2H5OH、O2的组成满足(CO)x(H2)y关系,反应后没有气体剩余,则反应完全后,体系内压强为零,据此进行解答.
解答 解:CO与H2在氧气中完全燃烧生成CO2和H2O,生成的CO2和H2O再与Na2O2反应;2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;
氢气燃烧2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,相当于是H2、CO与过氧化钠直接发生化合反应;
当C2H5OH与O2按照2:1混合时满足(CO)x(H2)y关系,反应后没有气体剩余,体系内压强为零,
选项中只有C满足条件,
关系C.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握过氧化钠的化学性质,试题有利于提高学生的分析能力及化学计算能力.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2aPa | B. | 2$\sqrt{a}$Pa | C. | $\frac{2}{3}$aPa | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、MnO4-、Na+、I- | B. | Mg2+、Na+、NO3-、CO32- | ||
| C. | AlO2-、NO3-、H+、SO42- | D. | CH3COO-、Na+、SO42-、H+、 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
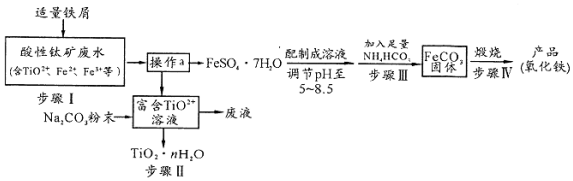
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能/(kJ•mol-1) | 356 | 413 | 226 | 318 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com