
分析 发生MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,n(MnO2)=$\frac{50g×78%}{87g/mol}$=0.49mol,n(HCl)=0.3L×12mol/L=3.6mol,由反应可知,HCl足量,以此来解答.
解答 解:n(MnO2)=$\frac{50g×78%}{87g/mol}$=0.49mol,n(HCl)=0.3L×12mol/L=3.6mol,
由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,MnO2完全反应,
可生成氯气为0.49mol×71g/mol=34.79g;
被氧化的氯化氢为0.49mol×2×36.5g/mol=35.77g;
转移电子数为0.49mol×(4-2)=0.98mol,
答:可生成34.79g氯气,有35.77g氯化氢被氧化,转移电子数为0.98mol.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及过量判断为解答本题的关键,侧重分析与计算的考查,注意物质的量的计算,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | B. | NH4+、Ba2+、OH-、NO3-(1:1:1:2) | ||
| C. | K+、H+、I-、AlO2-(1:1:1:1) | D. | Na+、Al3+、Cl-、OH-(4:1:4:3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液和Ca(OH)2溶液 | B. | NaHCO3溶液和Ca(OH)2溶液 | ||
| C. | Na2CO3溶液和稀盐酸 | D. | Na和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
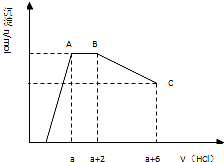 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示(已知::AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-)),下列结论不正确的是( )| A. | 溶液中一定不存在的离子:Fe3+,Mg2+,Al3+ | |
| B. | AB段可得到能使澄清的石灰水变浑浊的气体 | |
| C. | c(CO32-):c(AlO2-)=2:3 | |
| D. | BC段发生反应的离子方程式为Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(NH3•H2O)>n(NaOH) | |
| B. | 在氢氧化钠溶液中,c(OH)=1010mol/L | |
| C. | 在氨水中,c(OH)=c(NH4)+c(H) | |
| D. | 0.1mol/L的盐酸分别与等体积的氨水和氢氧化钠溶液恰好完全反应,氨水消耗的盐酸体积少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4:1 | B. | 3:1:2 | C. | 7:2:1 | D. | 9:3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com