
| A. | 石墨不如金刚石稳定 | |
| B. | 金刚石与石墨一样稳定 | |
| C. | 等质量的金刚石与石墨完全燃烧,放出的能量一样多 | |
| D. | 等质量的金刚石与石墨完全燃烧,石墨放出的能量少 |
科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液 | B. | H+浓度为1×10-6 mol/L的溶液 | ||
| C. | pH<7的溶液 | D. | c(OH-)<c(H+)的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  | 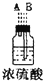 | 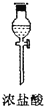 |  | 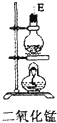 | 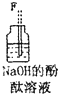 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.实验室制备氨基甲酸铵(NH2COONH4)的反应如下:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.实验室制备氨基甲酸铵(NH2COONH4)的反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是( )| A. | T1<T2 P1>P2 m+n<P Q<0 | B. | T1>T2 P1<P2 m+n>P Q>0 | ||
| C. | T1<T2 P1<P2 m+n<P Q>0 | D. | T1>T2 P1<P2 m+n>P Q<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青苹果中只含有淀粉而不含单糖 | B. | 熟苹果中只含有单糖而不含淀粉 | ||
| C. | 苹果转熟时淀粉水解为单糖 | D. | 苹果转熟时单糖聚合成淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4?Ba2++SO42- | B. | 2H2O?H3O++OH- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NH3•H2O═NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中的粒子一定不带电,胶体中的分散质粒子带电荷 | |
| B. | 电泳现象证明胶体带电荷 | |
| C. | 加入电解质,胶体可产生沉淀,而溶液不能 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现光亮的通路,前者则没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com