
【题目】指出下列化学反应类型(氧化、酯化、加成、取代)
(1)CH2Cl2+Br2![]() CHBrCl2+HBr _____________
CHBrCl2+HBr _____________
(2)CH2=CH2+Br2→CH2BrCH2Br __________
(3)![]() +HNO3
+HNO3![]()
![]() NO2 +H2O _______________
NO2 +H2O _______________
(4)![]() ___________
___________
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
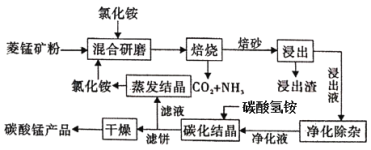
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
回答下列问题:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
(1)“焙烧”时发生的主要化学反应方程式为______________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:
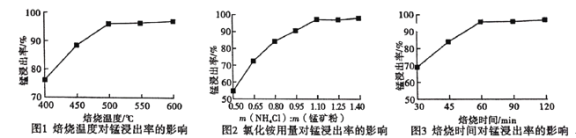
焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为____。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时, c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为_____________________________________________。
(5)流程中能循环利用的固态物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项的编号和曲线的编号一一对应,其中描述错误的是
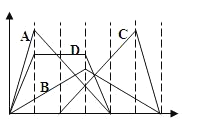
A. 向NaAlO2溶液中逐渐滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有无色盐溶液的试剂瓶,标签破损如右图,该小组根据已掌握的知识,对药品做出猜想,并设计实验验证。
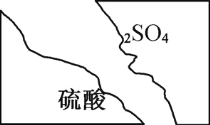
(1) 该实验药品为中学化学常用试剂,推测它的阳离子化合价为_______。
(2) 同学们做出以下三种推测。
猜想1:Na2SO4
实验设计:进行……,证明是Na2SO4溶液。
猜想2:K2SO4
实验设计:__________________________________,证明是K2SO4溶液。
猜想3:(NH4)2SO4
实验设计:________________________________,证明是(NH4)2SO4溶液。
(3) 通过实验发现“猜想3”成立,已知(NH4)2SO4受热易分解,该小组拟用下图所示装置探究其分解产物(夹持和加热装置略)。
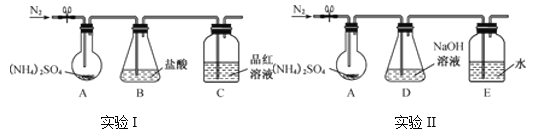
实验Ⅰ:装置B盛0.500 0 mol·L-1盐酸50.00 mL,通入N2排尽空气后,将装置A加热至260 ℃一段时间,停止加热,停止通入N2,品红溶液不褪色,取下装置B,用0.100 0 mol·L-1 NaOH溶液滴定剩余盐酸,消耗NaOH溶液50.00 mL。经检验滴定后的溶液中无SO42-。
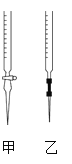
①请从如图选择盛放0.100 0 mol·L-1 NaOH 溶液的滴定管____(填“甲”或“乙”)。
②装置B 内溶液吸收气体的物质的量是_______mol。
实验Ⅱ:通入N2排尽空气后,将装置A加热到400 ℃至固体无残留,停止加热,停止通入N2,观察到装置A、D之间的导气管内有少量白色固体,经检验,该白色固体和装置D内溶液中有SO32-、无SO42-。
③装置E 的作用是__________。
④A、D之间的导气管内的少量白色固体是______。
⑤有同学提出在A、D之间需要增加一个防倒吸的安全瓶,老师说不需要,原因是___________。
⑥进一步研究发现,气体产物中无氮氧化物,则(NH4)2SO4在400 ℃分解的化学方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线a表示放热反应 X(g) + Y(g) + N(s) ![]() Z(g) + M(g)进行过程中X的转化率随时间变化的关系。在其它条件不变时改变某个条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + M(g)进行过程中X的转化率随时间变化的关系。在其它条件不变时改变某个条件,使反应过程按b曲线进行,可采取的措施是

A.升高温度B.加大X的投入量
C.缩小容器的体积D.增加N的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:![]() (Q>0),达到平衡后,改变一个条件,以下有关分析正确的是
(Q>0),达到平衡后,改变一个条件,以下有关分析正确的是
A.升高温度,正反应速率增大,化学平衡常数增大
B.减小压强,逆反应速率减小,化学平衡常数减小
C.加入催化剂,正逆反应速率不变,平衡不移动
D.充入氧气,正反应速率先增大后减小,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A、B、C均为气体)。
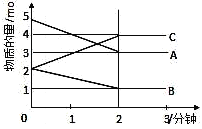
(1)该反应的的化学方程式为______________;
(2)反应开始至2分钟时,B的平均反应速率为______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将64 g铜放入300 mL某浓度硝酸中,当铜反应完全时,共收集到标准状况下NO、NO2混合气体22.4 L,下列说法正确的是
A.硝酸在反应中只表现为强氧化性B.参加反应硝酸的物质的量为3 mol
C.在反应过程中转移的电子数为3NAD.原硝酸的浓度一定为10 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素在医药、催化剂、新材料等领域有着广泛的应用。回答下列问题:
(1)下列有关说法正确的是_____。
A.铜元素焰色反应的光谱为吸收光谱
B.金属键没有方向性和饱和性
C.基态铁原子核外未成对电子有4个
D.锌属于过渡元素,处于元素周期表的d区
(2)[Co(NH3)5Br](NO3)3是钻元素形成的一种配位化合物。
①该配位化合物中心离子的价电子排布式为___,中心离子的配位数为____。
②该配位化合物中含氮离子的中心原子的杂化类型为______。
(3)①一种铝镍合金的结构如图,与其结构相似的化合物是_____。
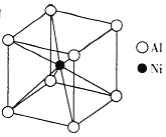
a.氯化钠
b.氯化铯
c.石英
d.金刚石
②NiO、CoO的晶体结构均属于NaC1型(Ni2+和Co2+的半径分别为69pm和74pm),NiO的熔点比CoO高,其原因是____。
③已知CuO![]() Cu2O+O2↑(未配平),试从结构的角度解释这一反应能够发生的原因_____。
Cu2O+O2↑(未配平),试从结构的角度解释这一反应能够发生的原因_____。
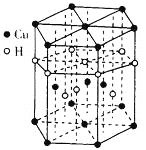
(4)Cu与H可形成一种红色晶体,其晶胞结构如图所示,则该化合物的化学式为____,一个晶胞的质量为_____g(NA为阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com