
【题目】某化学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有无色盐溶液的试剂瓶,标签破损如右图,该小组根据已掌握的知识,对药品做出猜想,并设计实验验证。
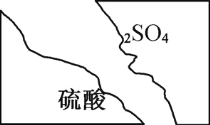
(1) 该实验药品为中学化学常用试剂,推测它的阳离子化合价为_______。
(2) 同学们做出以下三种推测。
猜想1:Na2SO4
实验设计:进行……,证明是Na2SO4溶液。
猜想2:K2SO4
实验设计:__________________________________,证明是K2SO4溶液。
猜想3:(NH4)2SO4
实验设计:________________________________,证明是(NH4)2SO4溶液。
(3) 通过实验发现“猜想3”成立,已知(NH4)2SO4受热易分解,该小组拟用下图所示装置探究其分解产物(夹持和加热装置略)。
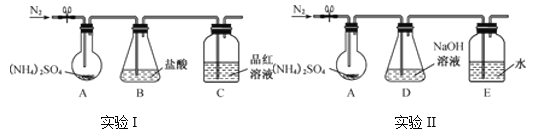
实验Ⅰ:装置B盛0.500 0 mol·L-1盐酸50.00 mL,通入N2排尽空气后,将装置A加热至260 ℃一段时间,停止加热,停止通入N2,品红溶液不褪色,取下装置B,用0.100 0 mol·L-1 NaOH溶液滴定剩余盐酸,消耗NaOH溶液50.00 mL。经检验滴定后的溶液中无SO42-。
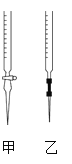
①请从如图选择盛放0.100 0 mol·L-1 NaOH 溶液的滴定管____(填“甲”或“乙”)。
②装置B 内溶液吸收气体的物质的量是_______mol。
实验Ⅱ:通入N2排尽空气后,将装置A加热到400 ℃至固体无残留,停止加热,停止通入N2,观察到装置A、D之间的导气管内有少量白色固体,经检验,该白色固体和装置D内溶液中有SO32-、无SO42-。
③装置E 的作用是__________。
④A、D之间的导气管内的少量白色固体是______。
⑤有同学提出在A、D之间需要增加一个防倒吸的安全瓶,老师说不需要,原因是___________。
⑥进一步研究发现,气体产物中无氮氧化物,则(NH4)2SO4在400 ℃分解的化学方程式是___________。
【答案】+1 进行焰色反应,透过蓝色钴玻璃观察,火焰呈紫色 取一定量溶液于试管中,加浓NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 乙 0.02 吸收NH3 (NH4)2SO3 (NH4)2SO4分解过程中不断通入N2,从而稀释了SO2,起到了防止倒吸的作用 3(NH4)2SO4![]() 4NH3↑+N2↑+3SO2↑+6H2O↑
4NH3↑+N2↑+3SO2↑+6H2O↑
【解析】
(1)根据破损标签,该物质的化学式应为A2SO4,即阳离子的化学式为+1价;
答案为+1价;
(2)猜想2:证明是K2SO4,需要证明含有钾元素,往往通过焰色反应确认钾元素,实验设计为进行焰色反应,透过蓝色钴玻璃观察,火焰呈紫色,说明该物质中含有钾元素,即该溶液为K2SO4;猜想3:证明是(NH4)2SO4,需要证明NH4+,检验NH4+方法:取一定量溶液于试管中,加浓NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,该气体为NH3,说明该溶液为(NH4)2SO4;
答案为进行焰色反应,透过蓝色钴玻璃观察,火焰呈紫色;取一定量溶液于试管中,加浓NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体;
(3)①甲为酸式滴定管,乙为碱式滴定管,盛放NaOH溶液的滴定管应是碱式滴定管,故乙正确;
答案为乙;
②加热(NH4)2SO4到260℃时不产生使品红溶液褪色的气体,即没有生成SO2,滴定后溶液中无SO42-,也就是没有生成SO3,则装置B中盐酸吸收分解产生的NH3,根据反应NaOH+HCl=NaCl+H2O,则吸收NH3消耗HCl的物质的量为(50. 00×10-3L×0.5000mol·L-1-50.00×10-3L×0.1000mol·L-1)=0.02mol,根据NH3+HCl=NH4Cl,则装置B内吸收NH3的物质的量为0.02mol;
答案为0.02mol;
③装置D内溶液中有SO32-,无SO42-,说明加热(NH4)2SO4到400℃时分解产生了SO2,装置A、D之间的导管内有少量的白色固体,白色固体应是SO2、H2O、NH3形成的盐,即(NH4)2SO4分解还产生了NH3和H2O,装置D的作用是吸收SO2,装置E的作用是吸收NH3;
答案为吸收NH3;
④根据③的分析,(NH4)2SO4加热到400℃分解生成的NH3、SO2、H2O,在A、D之间发生化合反应生成白色固体(NH4)2SO3;
答案为(NH4)2SO3;
⑤在A、D之间不需要增加防倒吸的安全瓶的原因是:虽然SO2易溶于水,当(NH4)2SO4分解过程中不断通入N2,N2难溶于水,N2稀释SO2,起到了防止倒吸的作用;
答案为(NH4)2SO4分解过程中不断通入N2,N2难溶于水,N2稀释SO2,起到了防止倒吸的作用
⑥根据上述分析,(NH4)2SO4加热到400℃分解生成SO2、NH3、H2O,S元素的化合价由+6价降至+4价,根据得失电子数目守恒,,只能为N元素的化合价升高,由于气体中无氮氧化物,,说明生成N2,根据得失电子守恒和原子守恒,分解的化学方程式为3(NH4)2SO4![]() 4NH3↑+N2↑+3SO2↑+6H2O;
4NH3↑+N2↑+3SO2↑+6H2O;
答案为3(NH4)2SO4![]() 4NH3↑+N2↑+3SO2↑+6H2O。
4NH3↑+N2↑+3SO2↑+6H2O。


科目:高中化学 来源: 题型:
【题目】(1)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因___________________________________。
(2)N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)铬原子的最高能层符号是_______,其价电子轨道表示式为____________________。
(4)比较第二电离能Cu_______Zn(填“>”、“=”、“<")。
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。写出Au2Cl6的结构式__________________________.
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,Au+与CN-形成的配离子为直线形. 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式___________________________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于古籍中的记载说法不正确的是
A. 《本草纲目》“烧酒”条目下写道自元时始创其法,用浓酒和糟入甑,蒸令气上其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
B. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚” 体现了合金硬度方面的特性
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
D. 《抱朴子·金丹篇》中记载:“丹砂(HgS)烧之成水银,积变又成丹砂”,该过程发生了分解、化合、氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 Fe+H2SO4=FeSO4+H2↑的能量变化趋势如下图所示:

(1)该反应为___________________(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施可行的是___________________(填字母)。
A.改铁片为铁粉 B.改稀硫酸为 98%的浓硫酸 C.升高温度 D.减小压强 E.加入少量的硝酸铜溶液 F.加入醋酸钠固体 G.加入氯化钠溶液
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_________(填“正”或“负”)极。铜片上产生的现象为_____________________ , 该 极 上 发 生 的 电 极 反 应 为___________________________,外电路中电子由_____(填“正”或“负”,下同)极向_____________极移动。
(4)若将电解质溶液改为 FeCl3,则形成原电池的总反应式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇结构式为 ,“箭头”表示乙醇发生化学反应时分子中可能断键的位置,下列叙述中不正确的是
,“箭头”表示乙醇发生化学反应时分子中可能断键的位置,下列叙述中不正确的是
A. 与钠反应时断裂①键 B. 发生消去反应时断裂②④键
C. 发生催化脱氢反应时断裂①③键 D. 与乙酸发生酯化反应时断裂②键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】指出下列化学反应类型(氧化、酯化、加成、取代)
(1)CH2Cl2+Br2![]() CHBrCl2+HBr _____________
CHBrCl2+HBr _____________
(2)CH2=CH2+Br2→CH2BrCH2Br __________
(3)![]() +HNO3
+HNO3![]()
![]() NO2 +H2O _______________
NO2 +H2O _______________
(4)![]() ___________
___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B. 常温下,78 g Na2O2中含有的阴离子数是2NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. pH=1的H2SO4溶液中,含有H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO + 2Ag(NH3)2+ +2OH-![]() CH3COONH4 + 3NH3 + 2Ag↓+ H2O
CH3COONH4 + 3NH3 + 2Ag↓+ H2O
B. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-→ 2C6H5OH + CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+ Ag+ =AgCl↓
D. 硫酸铝溶液中加入过量的氨水:Al3+ + 3NH3·H2O=Al(OH)3↓ + 3NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com