
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B. 常温下,78 g Na2O2中含有的阴离子数是2NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. pH=1的H2SO4溶液中,含有H+的数目为0.1NA
科目:高中化学 来源: 题型:
【题目】常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如下图,则下列说法正确的是( )

A. a点时溶液pH=11.5,原因是:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. a-b段发生反应为:CO32-+2H+ = CO2↑+H2O
C. b-c段发生反应为:HCO3-+H+ = CO2↑+H2O
D. c-d段发生反应为:H++OH- = H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:2 时,实际参加反应的FeS 与被还原的HNO3的物质的量之比为 ( )
A. 1:4 B. 1:5 C. 1:6 D. 1:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学知识,按以下步骤从 ![]() 合成
合成 ![]() .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
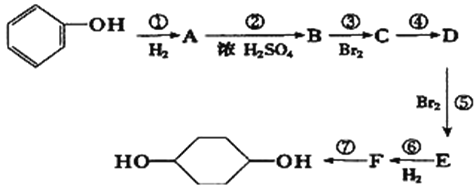
请回答下列问题:
(1)E中含有的官能团名称为____________;D的结构简式为________________
(2)④的反应类型为___________________。
(3)写出反应⑦的化学方程式______________________________________。
(4)![]() 的同分异构体中,能与NaHCO3溶液反应产生气泡的有__________种。
的同分异构体中,能与NaHCO3溶液反应产生气泡的有__________种。
(5)写出反应③的化学方程式______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是
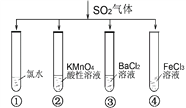
A. 试管①中有淡黄色沉淀生成,说明SO2有氧化性
B. 试管②中溶液褪色,说明SO2有漂白性
C. 试管③中能产生白色沉淀,说明SO2有酸性
D. 试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )

A. 紫色石蕊溶液先变红后褪色B. 品红溶液褪色
C. 溴水橙色褪去D. 含酚酞的NaOH溶液红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年9月我国科学家对于可充放电式锌一空气电池研究取得重大进展。电池装置如图所示,该电池的核心是驱动氧化还原反应(ORR)和析氧反应(OER),KOH溶液为电解质溶液,放电的总反应方程式为2Zn+O2+40H-+2H2O=2Zn(OH)2。下列有关说法正确的是( )

A. 可逆锌一空气电池实际上是二次电池,放电时电解质溶液中K+向负极移动
B. 在电池产生电力的过程中,空气进入电池,发生ORR反应,并释放OH-
C. 发生OER反应的电极反应式为2H2O-4e-=O2+4H+
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com