
| A. | 只有①②③ | B. | 只有①⑤ | C. | 只有③④⑤ | D. | 只有②⑤ |
分析 勒夏特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,以此解答该题.
解答 解:①钢铁在潮湿的空气中容易生锈是电化腐蚀原理,不是可逆反应,不能用勒夏特列原理解释,故选;
②氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?ClO-+2H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可以勒夏特列原理解释,故不选;
③常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,醋酸的电离平衡正向移动,所以会测得其pH<5,可以勒夏特列原理解释,故不选;
④该反应为可逆反应,能用勒夏特列原理解释,故不选;
⑤对2NO2?N2O4平衡体系增加压强,体积变小,浓度增大,颜色变深,不能用勒夏特列原理解释,故选.
故选B.
点评 本题考查了勒夏特列原理及其应用,题目难度中等,注意明确勒夏特列原理的内容及其应用方法,明确影响化学平衡的因素,试题培养了学生灵活应用所学知识解决实际问题达到能力.


科目:高中化学 来源: 题型:选择题
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Q | 与L同族 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
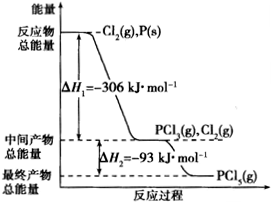 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol 任何气体的体积都约为22.4L | |
| B. | 1mol 任何物质在标准状况下所占的体积都约是22.4L | |
| C. | 标准状况下,1mol 水所占有的体积是22.4 L | |
| D. | 标准状况下,22.4L的任何气体的物质的量都约是1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
. 是一种重要的药物合成中间体,请结合题目所给信息,
是一种重要的药物合成中间体,请结合题目所给信息, 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH由大到小的顺序:②>③>① | B. | 水电离的C(H+):③>①>② | ||
| C. | C(NH4+):③>① | D. | ①②等体积混合后的溶液:C(H+)>C(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com