
【题目】水合肼(N2H4·H2O)是一种强还原性的碱性液体,是一种用途广泛的化工原料,实验室用如图装置制备(部分装置省略)。
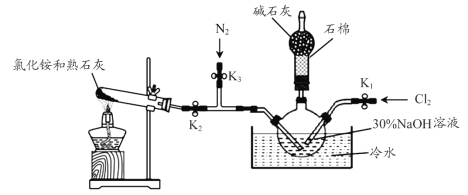
步骤1关闭K2、K3,打开K1,制备NaClO。
步骤2关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,通入NH3,制备N2H4·H2O。
回答下列问题:
(1)盛放碱石灰的仪器的名称为___________。
(2)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有__________(填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(3)步骤2中通入N2一段时间的原因是____________________。
(4)本装置中制备氨气的化学方程式是______________________________。
(5)NH3与NaClO反应生成N2H4·H2O的化学方程式为____________________。
【答案】干燥管 BD 排除空气及多余氯气 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 2NH3+NaClO=N2H4·H2O+NaCl
CaCl2+2NH3↑+2H2O 2NH3+NaClO=N2H4·H2O+NaCl
【解析】
(1)盛放碱石灰的仪器的名称为球形干燥管,故答案为:干燥管;
(2)配制30%NaOH溶液时,用天平称量质量,用量筒量取蒸馏水倒在烧杯中溶解NaOH固体,并用玻璃棒搅拌,需要玻璃仪器除量筒外还有烧杯、玻璃棒,故答案为:BD。
(3)步骤2中通入N2一段时间的原因是排除空气及多余氯气,故答案为:排除空气及多余氯气。
(4)本装置中使用氢氧化钙和氯化铵加热制备氨气的,反应的方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(5)NH3与NaClO反应生成N2H4·H2O和NaCl,化学方程式为:2NH3+NaClO=N2H4·H2O+NaCl,故答案为:2NH3+NaClO=N2H4·H2O+NaCl。


科目:高中化学 来源: 题型:
【题目】天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为:CH4 + 2O2![]() CO2 + 2H2O,C3H8 + 5O2
CO2 + 2H2O,C3H8 + 5O2![]() 3CO2 + 4H2O,现有一套以天然气为燃料的灶具,今改用液化石油气,应采取的正确措施是
3CO2 + 4H2O,现有一套以天然气为燃料的灶具,今改用液化石油气,应采取的正确措施是
A. 增大空气进入量或减小石油气进入量B. 增大空气进入量或增大石油气进入量
C. 减小空气进入量或减小石油气进入量D. 减小空气进入量或增大石油气进入量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
①N2(g)+O2(g) 2NO(g) △H=+180 kJ/mol
②N2(g)+2O2(g) 2NO2(g) △H=+68 kJ/mol
则2NO(g)+O2(g) 2NO2(g) △H=_____kJ/mol
(2)对于反应2NO(g)+O2(g) 2NO2(g)的反应历程如下:
第一步:2NO(g)![]() N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g)![]() 2NO(g)(慢反应)
2NO(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1 正·c2(NO),υ 逆=k1 逆·c(N2O2),k1正、k1 逆为速率常数,仅受温度影响。下列叙述正确的是_____
a.整个反应的速率由第一步反应速率决定
b.同一温度下,平衡时第一步反应的![]() 越大,反应正向程度越大
越大,反应正向程度越大
c.第二步反应速率慢,因而平衡转化率也低
d.第二步反应的活化能比第一步反应的活化能高
(3)将氨气与二氧化碳在有催化剂的反应器中反应![]() △H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
△H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
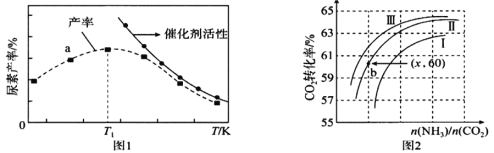
①a点_____(填是或不是)处于平衡状态,T1之后尿素产率下降的原因可能是 _____________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_____,测得b点氨的转化率为30%,则x=______________。
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_____,测得b点氨的转化率为30%,则x=______________。
(4)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:N2H4+H2ON2H5++OH- K1=![]() ;N2H5++H2ON2H62++OH - K2=
;N2H5++H2ON2H62++OH - K2=![]() ;
;
①25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+ )>c(N2H4 ),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围__________(用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某体积不变的密闭容器进行的可逆反应:3A(s) ![]() 2B(g)+C(g),下列各关系中能说明反应已达到平衡状态的是( )
2B(g)+C(g),下列各关系中能说明反应已达到平衡状态的是( )
A.生成 B和C的速率比为2:1B.生成2n molB同时生成n molC
C.混合气体的密度不变D.混合气体的平均相对分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。电池总反应为:2CH3OH+3O2→2CO2+4H2O。下列说法正确的是( )

A. 左电极为电池的负极,a处通入的物质是空气
B. 右电极为电池的负极,b处通入的物质是甲醇
C. 负极反应式为:CH3OH+H2O-6e-= CO2+6H+
D. 正极反应式为:O2+2H2O -4e-= 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种新型高分子材料的结构简式为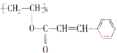 ,对此高聚物叙述不正确的是( )
,对此高聚物叙述不正确的是( )
A.化学式为(C11H10O2)n
B.可以发生水解反应、氧化反应,也能发生卤代反应
C.1 mol 该有机物分子最多能和4 mol H2发生加成反应
D.该高分子材料是经加聚反应而得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度,正反应方向是放热反应 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中.△H能正确表示物质的燃烧热的是( )
A.CO(g) +![]() O2(g) ==CO2(g); △H=-283.0 kJ/mol
O2(g) ==CO2(g); △H=-283.0 kJ/mol
B.C(s) +![]() O2 ==CO(g); △H=-110.5 kJ/mol
O2 ==CO(g); △H=-110.5 kJ/mol
C.H2(g) +![]() O2(g)==H2O(g); △H=-241.8 kJ/mol
O2(g)==H2O(g); △H=-241.8 kJ/mol
D.2C8H18(l) +25O2(g)==16 CO2(g)+18 H2O(l); △H=-1136 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2的制取及其在污水处理方面的应用是当前科学研究的热点。 回答下列问题:

(1)阴阳极同步产生过氧化氢和过硫酸铵[(NH4)2S2O8]的原理如图所示。阳极发生氧化反应的离子是_______,阴极的电极反应式为_________。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率见下表:
离子 | 加入量/(mg·L-1) | 分解率/% | 离子 | 加入量/(mg·L-1) | 分解率/% | |
无 | — | 2 | Fe3+ | 1.0 | 15 | |
Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 | |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧化氢时,可选用的容器材质为________(填标号)。
A 纯铝 B 黄铜 C 铸铁 D 不锈钢
(3)在弱碱性条件下,H2O2的一种催化分解机理如下:
H2O2(aq)+Mn2+(aq)=OH(aq)+Mn3+(aq)+OH-(aq) ΔH=a kJ/mol
H2O2(aq)+Mn3+(aq)+2OH-(aq)=Mn2+(aq)+·O2- (aq)+2H2O(l) Δ=b kJ/mol
OH(aq)+·O2-(aq)=O2(g)+OH-(aq) ΔH=c kJ/mol
则2H2O2(aq)=2H2O(l)+O2(g)的ΔH=_________,该反应的催化剂为________。
(4)298 K时,将10 mL a mol·L1 NaH2PO2、10 mL 2a mol·L1 H2O2溶液和10 mL NaOH溶液混合,发生反应:H2PO2-(aq)+2H2O2(aq)+2OH(aq)![]() PO43-(aq)+4H2O(l)。溶液中c(PO43-)与反应时间(t)的关系如图所示。
PO43-(aq)+4H2O(l)。溶液中c(PO43-)与反应时间(t)的关系如图所示。
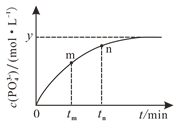
①下列可判断反应达到平衡的是_______(填标号)。
a c(H2PO2-)=y mol·L1
b 溶液的pH不再变化
c v(H2O2)=2v(H2PO2-)
d c(PO43-)/c(H2PO2-)不再变化
②tm时v逆_____tn时v逆(填“大于”“小于”或“等于”)。
③若平衡时溶液的pH=12,则该反应的平衡常数K为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com